题目内容
下列电离方程式中,正确的是( )
| A、Ca(OH)2═Ca2++2(OH)- |
| B、FeCl2═Fe2++3Cl- |
| C、H2SO4═H++SO42- |
| D、Al2(SO4)3═2Al3++3SO42- |
考点:电离方程式的书写
专题:离子反应专题
分析:用化学式和离子符号表示电离过程的式子,称为电离方程式,表示物质溶解于水时电离成离子的化学方程式.离子所带电荷数一般可根据它们在化合物中的化合价来判断.所有阳离子带的正电荷总数与所有阴离子所带的负电荷总数相等;强电解质在溶液中完全电离用等号表示;弱电解质在溶液中部分电离要用可逆号表示.
A.氢氧根离子无需用括号;
B.方程式左右电荷不守恒,氯离子前系数应为2;
C.方程式左右电荷不守恒,氢离子前系数应为2;
D.硫酸铝完全电离出铝离子和硫酸根离子.
A.氢氧根离子无需用括号;
B.方程式左右电荷不守恒,氯离子前系数应为2;
C.方程式左右电荷不守恒,氢离子前系数应为2;
D.硫酸铝完全电离出铝离子和硫酸根离子.
解答:
解:A.氢氧化钙属于强电解质,完全电离:Ca(OH)2═Ca2++2OH-,故A错误;
B.氯化亚铁属于强电解质,完全电离:FeCl2═Fe2++2Cl-,故B错误;
C.硫酸属于强电解质,完全电离:H2SO4═2H++SO42-,故C错误;
D.硫酸铝完全电离,该电离方程式离子书写正确,电荷守恒,故D正确;
故选D.
B.氯化亚铁属于强电解质,完全电离:FeCl2═Fe2++2Cl-,故B错误;
C.硫酸属于强电解质,完全电离:H2SO4═2H++SO42-,故C错误;
D.硫酸铝完全电离,该电离方程式离子书写正确,电荷守恒,故D正确;
故选D.
点评:本题考查了电离方程式的判断,掌握正确书写电离方程式的方法,并会判断离子方程式的正误,题目难度不大.

练习册系列答案
相关题目
关于电解质的下列说法中正确的是( )
| A、在水溶液中和熔化状态下能导电的化合物 |
| B、在水溶液中或熔化状态下能导电的物质 |
| C、在水溶液中或熔化状态下能导电的化合物 |
| D、在水溶液中或熔化状态下导电的离子由原物质本身电离出来的化合物 |
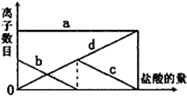 向一定的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中离子数目也相应地发生变化.如图所示,四条曲线与溶液中的离子的对应关系,完全正确的是( )
向一定的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中离子数目也相应地发生变化.如图所示,四条曲线与溶液中的离子的对应关系,完全正确的是( )| A、a:Cl-; b:K+; c:CO32-; d:HCO3- |
| B、a:K+; b:CO32-; c:Cl-; d:HCO3- |
| C、a:K+; b:CO32-; c:HCO3-; d:Cl- |
| D、a:K+; b:HCO3-;c:Cl-; d:CO32- |
某一反应物的浓度为1.0mol/L,经过20s后,它的浓度变成了0.2mol/L,在这20s内它的反应速率为( )
| A、0.04 |
| B、0.04mol/L |
| C、0.04mol/(L?S) |
| D、0.8mol/(L?S) |
下列反应的离子方程式正确的是( )
| A、碳酸氢钙溶液中加入足量的苛性钠溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O | ||||
B、电解饱和食盐水:2Cl-+2H2O
| ||||
| C、氯气通入冷的氢氧化钠溶液中:2Cl2+2OH-=3Cl-+ClO-+H2O | ||||
| D、FeBr2溶液中通入足量的Cl2:2Fe2++Cl2=2Fe3++2Cl- |
下列反应的离子方程式,书写错误的是( )
| A、硫酸氢钠溶液与氢氧化钠溶液:H++OH-=H2O |
| B、新制氯水跟溴化钾溶液反应:Cl2+2Br-=2Cl-+Br2 |
| C、钠与水:2Na+2H2O=2Na++2OH-+H2↑ |
| D、碳酸钙跟稀盐酸反应:CO32-+2H+=H2O+CO2↑ |