题目内容
3.下列表示正确的是( )| A. | 0.5mol氢 | B. | 1mol氧气 | C. | 1mole- | D. | 1mol氯化钠 |
分析 摩尔是物质的量的单位,摩尔只能用来计量微观粒子,不能计量宏观物质,且所指微观粒子要明确,应用符号表明微观粒子的种类或其特定组合(如分子、原子、离子、电子、质子、中子及其他有化学意义的特定组合),据此进行解答.
解答 解:A.0.5mol氢,没有指明是氢气分子还是原子,该表示不规范,故A错误;
B.1mol氧气,应该用氧气的分子式表示,正确的表示方法为1molO2,该表示方法不合理,故B错误;
C.1mole-,表示电子的物质的量为1mol,表示方法合理,故C正确;
D.1mol氯化钠,应该用氯化钠的化学式表示,正确的表示方法为1molNaCl,该表示方法步合理,故D错误;
故选C.
点评 本题考查了物质的量的表示方法,题目难度不大,试题注重了基础知识的考查,注意明确用物质的量表示粒子的方法必须指明表示何种微粒,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
相关题目
13.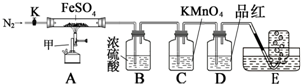 硫酸亚铁晶体(FeSO4•7H2O)俗称绿矾,加热至高温会分解.某化学研究小组利用如图装置探究FeSO4分解后的产物.
硫酸亚铁晶体(FeSO4•7H2O)俗称绿矾,加热至高温会分解.某化学研究小组利用如图装置探究FeSO4分解后的产物.
实验步骤:
按图组装好仪器(已省略夹持仪器)并检查装置的气密性,准确称取m gFeSO4固体置于硬质玻璃管中,将E中的导管撤出水槽,打开活塞K,通入一段时间的N2,关闭活塞K.加热A中的玻璃管一段时间后,将E中导管置于水槽集气瓶口收集产生的气体,用带火星的木条检验E中所收集的气体,带火星的木条能够复燃.待A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却,得到红棕色粉末.请回答下列问题:
(1)仪器甲的名称是酒精喷灯;
(2)B中浓硫酸的作用吸收分解产生的SO3;
(3)实验过程中发现C中溶液颜色变浅,D中无明显变化.写出C中发生反应的离子方程式5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+;
(4)FeSO4完全分解后,还需要通入一段时间N2的原因是将装置内残留的气体排入吸收装置2完全吸收,同时防止发生倒吸;
(5)若C中原先加入了20mL 1.00mol/L的KMnO4溶液,为了确定FeSO4分解的化学方程式,某同学进行了如下实验:
I、称量B装置在实验前后增重0.80g;
II、将实验后C中的溶液全部转移至100mL容量瓶中,并加水稀释至刻度线;
III、准确量取20.00mL溶液至锥形瓶中,加入足量稀硫酸酸化,用0.20mol/L标准H2C2O4溶液滴定至终点;
IV、重复实验3次,记录数据如表
①滴定至终点的现象溶液由紫红色变为无色且半分钟不恢复成紫红色;
②FeSO4分解的化学方程式为8FeSO4 $\frac{\underline{\;高温\;}}{\;}$4Fe2O3+2SO3↑+6SO2↑+O2↑;
(6)请设计一个实验来检验A中的FeSO4是否完全分解将废液后的固体转移到小烧杯中,加入少量水搅拌过滤,取少量滤液于试管中,加入几滴K3[Fe(CN)6]溶液,若产生特征蓝色沉淀,说明硫酸亚铁未全部分解,反之则分解完全.
 硫酸亚铁晶体(FeSO4•7H2O)俗称绿矾,加热至高温会分解.某化学研究小组利用如图装置探究FeSO4分解后的产物.
硫酸亚铁晶体(FeSO4•7H2O)俗称绿矾,加热至高温会分解.某化学研究小组利用如图装置探究FeSO4分解后的产物.实验步骤:
按图组装好仪器(已省略夹持仪器)并检查装置的气密性,准确称取m gFeSO4固体置于硬质玻璃管中,将E中的导管撤出水槽,打开活塞K,通入一段时间的N2,关闭活塞K.加热A中的玻璃管一段时间后,将E中导管置于水槽集气瓶口收集产生的气体,用带火星的木条检验E中所收集的气体,带火星的木条能够复燃.待A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却,得到红棕色粉末.请回答下列问题:
(1)仪器甲的名称是酒精喷灯;
(2)B中浓硫酸的作用吸收分解产生的SO3;
(3)实验过程中发现C中溶液颜色变浅,D中无明显变化.写出C中发生反应的离子方程式5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+;
(4)FeSO4完全分解后,还需要通入一段时间N2的原因是将装置内残留的气体排入吸收装置2完全吸收,同时防止发生倒吸;
(5)若C中原先加入了20mL 1.00mol/L的KMnO4溶液,为了确定FeSO4分解的化学方程式,某同学进行了如下实验:
I、称量B装置在实验前后增重0.80g;
II、将实验后C中的溶液全部转移至100mL容量瓶中,并加水稀释至刻度线;
III、准确量取20.00mL溶液至锥形瓶中,加入足量稀硫酸酸化,用0.20mol/L标准H2C2O4溶液滴定至终点;
IV、重复实验3次,记录数据如表
| 实验 | 滴定管开始读数 | 滴定终点读数 |
| 1 | 0 | 19.98 |
| 2 | 0.10 | 20.12 |
| 3 | 0 | 20.16 |
②FeSO4分解的化学方程式为8FeSO4 $\frac{\underline{\;高温\;}}{\;}$4Fe2O3+2SO3↑+6SO2↑+O2↑;
(6)请设计一个实验来检验A中的FeSO4是否完全分解将废液后的固体转移到小烧杯中,加入少量水搅拌过滤,取少量滤液于试管中,加入几滴K3[Fe(CN)6]溶液,若产生特征蓝色沉淀,说明硫酸亚铁未全部分解,反之则分解完全.
14.乙醇分子中的各种化学键如图所示,关于乙醇在各种反应中断键的说明错误的是( )


| A. | 和金属钠反应时断①键 | B. | 和乙酸反应时断②键 | ||
| C. | 在铜催化共热下与O2反应时断①③键 | D. | 在空气中完全燃烧时断①②③④⑤键 |
11.下列对三种有机物的叙述不正确的是( )
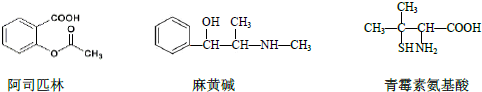

| A. | 三种有机物都能发生酯化反应 | |
| B. | 阿司匹林的苯环上的一氯代物有3 种 | |
| C. | 麻黄碱的分子式是C10H15NO,苯环上的一硝基取代物有3 种 | |
| D. | 青霉素氨基酸既能与盐酸反应,又能与NaOH 溶液反应 |
18.A1-KMnO4电池具有高能量的特点,在生产生活中应用广泛,电极反应式为A1+Mn04-═AlO2-+MnO2,装置如图所示.该电池工作时,以下说法正确的是( )
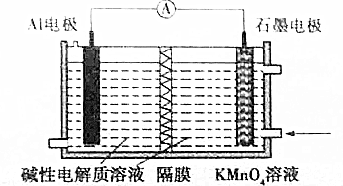

| A. | 溶液中OH-向石墨极移动 | |
| B. | A1电极附近溶液的pH保持不变 | |
| C. | 石墨极的电极反应式为MnO4-+3e-+4H═MnO2+2H2O | |
| D. | KMnO4中锰元素价态高,因此在同条件下放电容量比MnO2的大 |
8.某矿石的主要成分是由前20号元素中的4种组成,其化学式为WmYnZpZq.X、Y、Z、W分布在三个周期,原子序数依次增大,W、Y为金属元素,X原子的最外层电子数是次外层电子数的3倍,W的单质能与冷水剧烈反应,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等,Y、Z位于同周期,Z的单质是一种良好的半导体.下列说法正确的是( )
| A. | 气态氢化物的稳定性:X<Z | |
| B. | Y的氯化物为离子化合物 | |
| C. | W位于第3周期IA族,其原子半径比其他元素的都大 | |
| D. | 将2 mol W的单质和1 mol Y的单质投入足量的水中会产生2.5 mol气体 |
5.铁与氯化铁溶液反应时,氧化产物与还原产物的质量比是( )
| A. | 2:1 | B. | 3:1 | C. | 3:2 | D. | 1:2 |
6.下列说法中错误的是( )
| A. | 温度越高,酶的催化活性越强 | |
| B. | 浓硝酸使皮肤呈黄色是由于浓硝酸与蛋白质发生了显色反应 | |
| C. | 用灼烧的方法可以鉴别毛织物和棉织物 | |
| D. | 在豆浆中加入少量的石膏,能使豆浆凝结为豆腐 |