题目内容
7.化学与生活、生产密切相关.下列说法不正确的是( )| A. | 利用氯气的氧化性对自来水进行消毒杀菌处理 | |
| B. | 燃料燃烧产物CO2是温室气体之一 | |
| C. | 利用太阳能、潮汐能、风力发电,可以获取清洁能源 | |
| D. | 金属钠着火,不能用水来灭火 |
分析 A.利用次氯酸的强氧化性;
B.二氧化碳可导致温室效应;
C.太阳能、潮汐能、风力发电等,都为清洁能源;
D.钠易与水反应.
解答 解:A.氯气与水反应生成次氯酸,次氯酸具有强氧化性,可起到杀菌消毒的作用,故A错误;
B.燃料燃烧可生成二氧化碳,二氧化碳可导致温室效应,故B正确;
C.太阳能、潮汐能、风力发电等对环境没有污染,都为清洁能源,故C正确;
D.钠易与水反应,不能用水扑灭,应用沙土盖灭,故D正确.
故选A.
点评 本题综合考查物质的结构和性质,为高频考点和常见题型,侧重于化学与生活、生产的考查,注意相关基础知识的积累,题目难度不大.

练习册系列答案
相关题目
15.设NA为阿伏伽德罗常数的值,则下列说法正确的是( )
| A. | 0.4mol AgNO3受热完全分解(2AgNO3$\frac{\underline{\;\;△\;\;}}{\;}$2Ag+2NO2↑+O2↑),用排水法最终收集到气体的分子数为0.2NA | |
| B. | 6.4g CaC2中含有的离子总数目为0.3NA | |
| C. | 1 mol FeI2与一定量氯气反应时,若已知有1mol Fe2+被氧化则转移的电子数为3NA | |
| D. | 1mol 苯和苯甲酸的混合物完全燃烧时消耗O2的分子数为7.5NA |
15. 25℃时,FeS和ZnS的饱和溶液中,金属阳离子与S2-的物质的量浓度的负对数关系如图所示.下列说法正确的是( )
25℃时,FeS和ZnS的饱和溶液中,金属阳离子与S2-的物质的量浓度的负对数关系如图所示.下列说法正确的是( )
 25℃时,FeS和ZnS的饱和溶液中,金属阳离子与S2-的物质的量浓度的负对数关系如图所示.下列说法正确的是( )
25℃时,FeS和ZnS的饱和溶液中,金属阳离子与S2-的物质的量浓度的负对数关系如图所示.下列说法正确的是( )| A. | 溶解度S(FeS)<S(ZnS) | |
| B. | a点表示FeS的不饱和溶液,且c(Fe2+)>c(S2-) | |
| C. | 向b点对应溶液中加入Na2S溶液,可转化为c点对应的溶液 | |
| D. | 向c点对应的溶液中加入Na2S溶液,ZnS的KSP增大 |
12.a、b、c、d为四种短周期元素,a的原子M电子层有l个电子,b是地壳中含量最多的金属元素,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c.关于这四种元素下列叙述错误的是( )
| A. | a、c、d均存在两种以上的氧化物 | |
| B. | b的氧化物与d的最高价氧化物对应水化物反应后的溶液呈酸性 | |
| C. | a是短周期中金属性最强的元素 | |
| D. | 工业上是通过电解b、d形成的化合物制取b单质 |
19.下列叙述正确的是( )
| A. | 乙烷中混有乙烯可用酸性高锰酸钾溶液来除去 | |
| B. | 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 | |
| C. | 已知2SO2(g)+O2(g)?2SO3(g)△H<0,该反应在任何温度下均可自发进行 | |
| D. | 室温下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=9.0×10-12,向浓度相等的Na2CrO4和NaCl的混合稀溶液中滴加0.01 mol•L-1 AgNO3溶液,先生成Ag2CrO4沉淀 |
16.25℃时,下列溶液中微粒的物质的量浓度关系不正确的是( )
| A. | 0.1mol•L-1NaHC2O4溶液(pH=5.5):c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4) | |
| B. | 0.1mol•L-1NaHS溶液:c(OH-)+c(S2-)=c(H+)+c(H2S) | |
| C. | 0.1mol•L-1CH3COOH溶液和0.1mol•L-1CH3COONa溶液等体积混合:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
17.己知A、B、C、D为短周期元素组成的四种物质,且D为强电解质.在一定条件下有如下转化关系:A$\stackrel{O_{2}}{→}$B$\stackrel{O_{2}}{→}$C$\stackrel{H_{2}O}{→}$D(其他相关物质可能省略).下列说法不正确的是( )
| A. | A不可能为碳单质 | |
| B. | 若A为金属单质,则 A-定位于第三周期第IA族 | |
| C. | 若常温下D的浓溶液能使铁、铝钝化,则A可能是单质,也可能是化合物 | |
| D. | 若A是共价化合物,A的水溶液一定显碱性 |
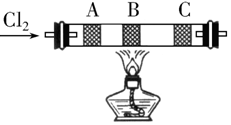 在硬质玻璃管中的A、B、C处依次放有浸有KBr溶液、KI溶液、淀粉(已知淀粉遇I2显蓝色)溶液的3个棉球(如图所示).由左端通入氯气,在B处加热,可观察到A处棉球呈橙色,B处棉球呈现黄色,C处棉球呈蓝色.将玻璃管冷却后,在B、C之间的玻璃壁上有紫黑色的固体(填物质状态),这是因为碘易升华.A、B两处发生的离子方程式分别是:Cl2+2Br-=Br2+2Cl-、Cl2+2I-=I2+2Cl-.
在硬质玻璃管中的A、B、C处依次放有浸有KBr溶液、KI溶液、淀粉(已知淀粉遇I2显蓝色)溶液的3个棉球(如图所示).由左端通入氯气,在B处加热,可观察到A处棉球呈橙色,B处棉球呈现黄色,C处棉球呈蓝色.将玻璃管冷却后,在B、C之间的玻璃壁上有紫黑色的固体(填物质状态),这是因为碘易升华.A、B两处发生的离子方程式分别是:Cl2+2Br-=Br2+2Cl-、Cl2+2I-=I2+2Cl-.