题目内容
在一密闭容器中,CO和H2O混合加热到850℃达到下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g),K=1.0,若反应开始时CO和H2O的浓度分别为0.20mol/L和1.00mol/L,则CO转化为CO2的转化率为( )
| A、5% | B、80% |
| C、83% | D、91% |
考点:化学平衡的计算
专题:化学平衡专题
分析:令平衡时参加反应的CO的物质的量浓度为xmol,根据三段式用x表示出平衡时各组分的物质的量浓度,利用物质的量浓度代入平衡常数K中计算x的值,再根据转化率定义计算比较.
解答:
解:令平衡时参加反应的CO的物质的量浓度为xmol/L,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
开始(mol/L):0.2 1 0 0
变化(mol/L):x x x x
平衡(mol/L):0.2-x 1-x x x
所以
=1,解得x=
mol/L,
故CO的转化率为
×100%=83%,
故选:C.
CO(g)+H2O(g)?CO2(g)+H2(g)
开始(mol/L):0.2 1 0 0
变化(mol/L):x x x x
平衡(mol/L):0.2-x 1-x x x
所以
| x 2 |
| (0.2-x)×(1-x) |
| 1 |
| 6 |
故CO的转化率为
| ||
| 0.2 |
故选:C.
点评:本题考查化学平衡常数的有关计算,注意平衡常数的概念应用,掌握基础是关键,题目难度中等.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
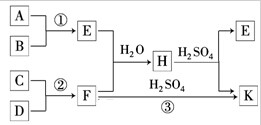
 某课外小组同学拟用乙醇分解法制乙烯,并对该反应进行探究.
某课外小组同学拟用乙醇分解法制乙烯,并对该反应进行探究. 某同学受2Mg+CO2
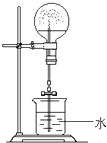
某同学受2Mg+CO2 实验室可用酒精、浓硫酸作试剂来制取乙烯,但实验表明,还有许多副反应发生,如反应中会生成SO2、CO2、水蒸气等无机物.某研究性学习小组欲用如图所示的装置制备纯净的乙烯并探究乙烯与单质溴能否反应及反应类型.回答下列问题:
实验室可用酒精、浓硫酸作试剂来制取乙烯,但实验表明,还有许多副反应发生,如反应中会生成SO2、CO2、水蒸气等无机物.某研究性学习小组欲用如图所示的装置制备纯净的乙烯并探究乙烯与单质溴能否反应及反应类型.回答下列问题: