题目内容
下列有关阿伏加德罗常数(NA)的说法错误的是( )
| A、32 g O2所含的原子数目为NA |
| B、0.5 mol H2O含有NA个氢原子和0.5NA个氧原子 |
| C、1 mol H2O含有的H2O分子数目为NA |
| D、0.5NA个氢气分子的物质的量是0.5 mol |
考点:阿伏加德罗常数
专题:
分析:A.32g氧气的物质的量1mol,1mol氧气分子中含有2mol氧原子;
B.0.5mol水分子中含有1mol氢原子、0.5mol氧原子;
C.根据N=nNA计算出含有的分子数;
D.根据n=
计算出0.5NA个氢气分子的物质的量.
B.0.5mol水分子中含有1mol氢原子、0.5mol氧原子;
C.根据N=nNA计算出含有的分子数;
D.根据n=
| N |
| NA |
解答:
解:A.32g氧气的物质的量1mol,含有2mol氧原子,所含的原子数目为2NA,故A错误;
B.0.5molH2O含有1mol氢原子、0.5mol氧原子,含有NA个氢原子和0.5NA个氧原子,故B正确;
C.1 mol H2O分子中含有NA个水分子,故C正确;
D.0.5NA个氢气分子的物质的量为:
=0.5mol,故D正确;
故选A.
B.0.5molH2O含有1mol氢原子、0.5mol氧原子,含有NA个氢原子和0.5NA个氧原子,故B正确;
C.1 mol H2O分子中含有NA个水分子,故C正确;
D.0.5NA个氢气分子的物质的量为:
| 0.5NA |
| NA |
故选A.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系,试题有利于提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在溶液导电性实验装置里,分别注入同体积同浓度的H2SO4溶液与Ba(OH)2溶液,灯光明暗程度相似.如果把这两种溶液混合后再实验,则( )
| A、灯光明暗程度不变 |
| B、灯光变暗或不亮 |
| C、灯光变亮 |
| D、无法判断 |
几难溶物质的有关数值如表所示:下列关于含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法正确的是( )
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-36 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | ≥3 |
| A、向该混合溶液中逐滴加入NaOH溶液,最先看到蓝色沉淀 |
| B、该溶液中c(SO42-):[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5:4 |
| C、当pH=10时,溶液中c(Fe2+):c(Fe3+)=2×1020:1 |
| D、向该溶液中加入适量氨,调节pH到9.6后过滤,将所得的沉淀灼烧,可得等物质的量的CuO、FeO、Fe2O3三种固体的混合物 |
在标准状况下有一定量的气体如下:①6.72L CH4、②3.01×1023个HCl分子、③13.6g H2S、④0.2mol NH3,下列对这四种气体的关系从大到小排列的组合中正确的是( )
a.体积:②>③>①>④b.密度:②>③>④>①
c.质量:②>③>①>④d.氢原子:①>③>④>②
a.体积:②>③>①>④b.密度:②>③>④>①
c.质量:②>③>①>④d.氢原子:①>③>④>②
| A、abc | B、bcd |
| C、abc | D、abcd |
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、2.4g金属镁所含电子数目为0.2NA |
| B、16gCH4所含原子数目为NA |
| C、17gNH3所含电子数目为NA |
| D、18g水所含分子数目为NA |
下列说法正确的是( )
| A、准状况下,1 mol任何物质体积均为22.4L |
| B、2g H2含1mol H |
| C、氧气的摩尔质量是32 g/mol |
| D、3.01×1023个SO2分子的质量为64g |
分类法在化学学科的发展中起到了非常重要的作用,下列分类标准合理的是( )
| A、根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
| B、根据水溶液是否导电,将物质分为电解质和非电解质 |
| C、根据是否含氧元素,将物质分为氧化剂和还原剂 |
| D、根据反应中是否有电子转移,将化学反应分为氧化还原反应和非氧化还原反应 |
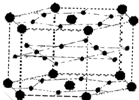 A、B、C、D、E、F六种元素,A、B、C属于第四周期且单质均为固体.基态时,A、B原子核外电子均成对,且核电荷数A>B,原子半径A<B;C与A在周期表属于同一区的元素,原子半径接近.如图是金属B和C所形成的某种合金的晶胞结构示意图;D、E、F在周期表中属于同一区,D原子在基态时p轨道半充满且电负性是同族元素中最大的;E的逐级电离能数据有两次突跃,E原子的第一电离能至第四电离能(kJ/mol)分别为:578、1817、2745、11575;F原子有三个能层,E与F能形成原子数目比为1:3,熔点为190℃的化合物Q.请回答:
A、B、C、D、E、F六种元素,A、B、C属于第四周期且单质均为固体.基态时,A、B原子核外电子均成对,且核电荷数A>B,原子半径A<B;C与A在周期表属于同一区的元素,原子半径接近.如图是金属B和C所形成的某种合金的晶胞结构示意图;D、E、F在周期表中属于同一区,D原子在基态时p轨道半充满且电负性是同族元素中最大的;E的逐级电离能数据有两次突跃,E原子的第一电离能至第四电离能(kJ/mol)分别为:578、1817、2745、11575;F原子有三个能层,E与F能形成原子数目比为1:3,熔点为190℃的化合物Q.请回答: