题目内容
下面的说法正确的是( )
| A、相同条件下浓度相同的氨水和氢氧化钠溶液的导电能力相同 |
| B、向1L 0.1 mol?L-1醋酸溶液中通入0.1mol氨气后,溶液的导电能力明显增强 |
| C、在1L 0.1mol?L-1的盐酸溶液中加入0.1mol的硝酸银固体后,溶液的导电能力明显变化 |
| D、相同条件下等浓度的硫酸钠溶液和氯化钠溶液的导电能力相同 |
考点:电解质溶液的导电性,弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:根据溶液的导电性强弱取决于溶液中离子浓度的大小,离子浓度越大,导电性越强来回答.
解答:
解:A、由于氨水是弱电解质,部分电力,氢氧化钠是强电解质,完全电离,因此相同条件下浓度相同的氨水和氢氧化钠溶液,后者离子浓度大,后者导电能力强,故A错误;
B、醋酸溶液中通入氨气后,反应生成醋酸铵,从原来的弱电解质变为强电解质,溶液的导电能力明显增强,故B正确;
C、盐酸溶液中加入硝酸银固体后,发生反应生成氯化银和硝酸,硝酸的导电能力和盐酸相近,溶液的导电能力几乎无明显变化,故C错误;
D、相同条件下等浓度的硫酸钠溶液比氯化钠溶液的离子浓度大,导电能力强,故D错误.
故选B.
B、醋酸溶液中通入氨气后,反应生成醋酸铵,从原来的弱电解质变为强电解质,溶液的导电能力明显增强,故B正确;
C、盐酸溶液中加入硝酸银固体后,发生反应生成氯化银和硝酸,硝酸的导电能力和盐酸相近,溶液的导电能力几乎无明显变化,故C错误;
D、相同条件下等浓度的硫酸钠溶液比氯化钠溶液的离子浓度大,导电能力强,故D错误.
故选B.
点评:本题考查了溶液导电能力的强弱判断,注意导电性与离子浓度、离子电荷的关系即可解答,较简单.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
下列物质的主要成分正确的是( )
| A、赤铁矿:Fe3O4 |
| B、小苏打:NaHCO3 |
| C、磁铁矿:Fe2O3 |
| D、明矾:KAl(SO4)2 |
已知自然界氧的同位素160、17O、18O,碳酸钙的同位素有16C、18C,从二氧化碳酸饮料分子的原子组成来看.自然界的CO2一共有( )
| A、3种 | B、6种 | C、9种 | D、12种 |
鲨鱼是世界上惟一不患癌症的动物,科学研究表明,鲨鱼体内含有一种角鲨烯,具有抗癌性.实验测得角鲨烯分子是链状结构,分子中含有30个碳原子且碳氢质量比为7.2:1,下列说法不正确的是( )
| A、角鲨烯分子式为C30H50 |
| B、1mol角鲨烯最多可与6mol溴单质加成 |
| C、角鲨烯与分子式为C29H48的物质可能属于同系物 |
| D、角鲨烯是高分子化合物 |
化学与生产、生活、社会密切相关,下列说法正确的是( )
| A、煤经气化和液化两个物理过程后可变为清洁能源,这是煤综合利用的主要方法 |
| B、蛋白质、淀粉、纤维素、油脂等都能在人体内水解并提供能量 |
| C、利用风能发电、使用太阳能热水器、应用无氟制冷剂均有利于降低大气中的二氧化碳 |
| D、塑料袋在全球“失宠”,有偿使用成为风尚,是因为塑料袋填埋占用土地,且难以降解,会造成“白色污染” |
下列化学方程式中,不能用离子方程式Ba2++SO42-═BaSO4 表示的是( )
| A、BaCl2+K2SO4═BaSO4+2 KCl |
| B、Ba(OH)2+K2SO4═BaSO4+2 KOH |
| C、Ba(NO3)2+H2SO4═BaSO4+2 HNO3 |
| D、Ba(OH)2+H2SO4═BaSO4+2 H2O |
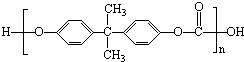 2010年5月1日上海世博会隆重开幕,世博会的环保概念是人们关心的话题,环保材料更为世人瞩目,其中聚碳酸酯是用得较多的材料.聚碳酸酯的结构简式如图所示,下列说法正确的是( )
2010年5月1日上海世博会隆重开幕,世博会的环保概念是人们关心的话题,环保材料更为世人瞩目,其中聚碳酸酯是用得较多的材料.聚碳酸酯的结构简式如图所示,下列说法正确的是( )| A、它在结构上可以看成由碳酸和另一有机物通过缩聚反应而成 |
| B、该有机物是一种高分子化合物,肯定易溶于水 |
| C、它是一种纯净物,属于酯类物质 |
| D、它耐强酸,强碱,不可与强氧化剂发生反应 |
X、Y、Z、W是前20号元素中的4种元素,分布在三个周期,原子序数依次增大,它们可以组成某矿物质:WYZX,四种元素中W,Y为金属元素,X原子的最外层电子数是次外层电子数的3倍,W能与冷水剧烈反应,Y,Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等,Y、Z位于同周期,Z单质是一种良好的半导体.下列说法不正确的是( )
| A、原子半径:W>Y>Z>X |
| B、气态氢化物的稳定性:X>Z |
| C、金属性:Y<W |
| D、Y、Z的氧化物都能和酸或碱反应,都是两性氧化物 |