题目内容
12.配制50g溶质的质量分数为 6%的氯化钠溶液,不需要的仪器是( )| A. | 蒸发皿 | B. | 玻璃棒 | C. | 烧杯 | D. | 量筒 |
分析 配制50g溶质的质量分数为6%的氯化钠溶液的操作步骤分别是:计算、称量、溶解,根据各操作所需要使用的仪器.
解答 解:配制50g溶质的质量分数为6%的氯化钠溶液的操作步骤分别是:计算、称量、溶解,将称量好的溶质在烧杯中溶解,用量筒量取适量的蒸馏水,用玻璃棒搅拌,用不到蒸发皿;
故选:A.
点评 本题考查了配制一定质量分数浓度溶液仪器的选择,明确操作步骤及各步使用的仪器是解题关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品中的重要成分.下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
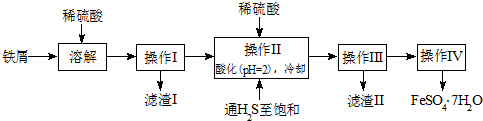
已知:室温下饱和H2S溶液的pH约为3.9;SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5.
请回答下列问题:
(一)绿矾的制备
(1)检验制得的绿矾中是否含有Fe3+的实验操作是取少量溶于水配成溶液,滴加1~2滴KSCN溶液,振荡,若变为红色溶液则含有Fe3+,否则不含Fe3+.
(2)操作II中,通入硫化氢至饱和的目的是把Fe3+还原成Fe2+,除去溶液中的Sn2+,并防止Fe2+被氧化;在溶液中用硫酸酸化至pH=2的目的是防止Fe2+生成沉淀.
(3)操作IV的顺序依次为:蒸发浓缩、冷却结晶、过滤洗涤.
(二)绿矾中FeSO4•7H2O含量的测定
若用容量法测定绿矾中FeSO4•7H2O的含量.滴定反应是:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
实验方案如下:
①称取15.041g绿矾产品,溶解,在250mL容量瓶中定容.
②量取25.00mL待测溶液于锥形瓶中.
③用0.0500mol/L KMnO4溶液(硫酸酸化)滴定至终点,记录初读数和末读数.
④重复操作②③1~2次或做平行实验1~2次.
⑤数据处理.
(4)上述实验方案中的步骤④是重复操作②③1~2次或做平行实验1~2次.
(5)洁净的滴定管在滴定前必须进行的操作有:
①检验活塞是否漏水;②用蒸馏水洗涤2~3次,再用高锰酸钾标准溶液润洗滴定管2~3次;
③向滴定管中加入KMnO4标准溶液到0刻度以上,赶走尖嘴部位的气泡,调液面至0或0刻度线以下,初读数.
(三)数据处理
某小组同学的实验数据记录如下:(FeSO4•7H2O的摩尔质量为278g/mol)
(6)上述样品中FeSO4•7H2O的质量分数为0.975(用小数表示,保留三位小数).

已知:室温下饱和H2S溶液的pH约为3.9;SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5.
请回答下列问题:
(一)绿矾的制备
(1)检验制得的绿矾中是否含有Fe3+的实验操作是取少量溶于水配成溶液,滴加1~2滴KSCN溶液,振荡,若变为红色溶液则含有Fe3+,否则不含Fe3+.
(2)操作II中,通入硫化氢至饱和的目的是把Fe3+还原成Fe2+,除去溶液中的Sn2+,并防止Fe2+被氧化;在溶液中用硫酸酸化至pH=2的目的是防止Fe2+生成沉淀.
(3)操作IV的顺序依次为:蒸发浓缩、冷却结晶、过滤洗涤.
(二)绿矾中FeSO4•7H2O含量的测定
若用容量法测定绿矾中FeSO4•7H2O的含量.滴定反应是:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
实验方案如下:
①称取15.041g绿矾产品,溶解,在250mL容量瓶中定容.
②量取25.00mL待测溶液于锥形瓶中.
③用0.0500mol/L KMnO4溶液(硫酸酸化)滴定至终点,记录初读数和末读数.
④重复操作②③1~2次或做平行实验1~2次.
⑤数据处理.
(4)上述实验方案中的步骤④是重复操作②③1~2次或做平行实验1~2次.
(5)洁净的滴定管在滴定前必须进行的操作有:
①检验活塞是否漏水;②用蒸馏水洗涤2~3次,再用高锰酸钾标准溶液润洗滴定管2~3次;
③向滴定管中加入KMnO4标准溶液到0刻度以上,赶走尖嘴部位的气泡,调液面至0或0刻度线以下,初读数.
(三)数据处理
某小组同学的实验数据记录如下:(FeSO4•7H2O的摩尔质量为278g/mol)
| 实验次数 | 初读数(mL) | 末读数(mL) |
| 1 | 0.20 | 21.40 |
| 2 | 0.00 | 21.00 |
| 3 | 1.60 | 26.60 |
3.下列离子方程式正确的是( )
| A. | NaHCO3溶液中加足量Ba(OH)2 溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O | |
| B. | 酸性溶液中KIO3与 KI反应生成 I2:IO3-+I-+6H+=I2+3H2O | |
| C. | NaHCO3 溶液与稀硫酸反应:CO32-+2H+=H2O+CO2↑ | |
| D. | 碳酸氢镁溶液中加入过量石灰水:Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+MgCO3↓ |
17.以极性键结合的多原子分子,分子是否有极性取决于分子的空间构型.下列分子都属于含极性键的非极性分子的是( )
| A. | CO2 H2O | B. | NH3 BCl3 | C. | PCl3 CH4 | D. | PCl5 CH4 |
2.下列分子晶体中,关于熔沸点高低的比较,正确的是( )
| A. | Cl2>I2 | B. | SiCl4>CCl4 | ||
| C. | NH3>PH3 | D. | C(CH3)4>CH3CH2CH2CH2CH3 |
 .
. .
.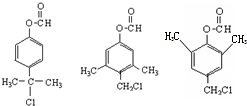 .
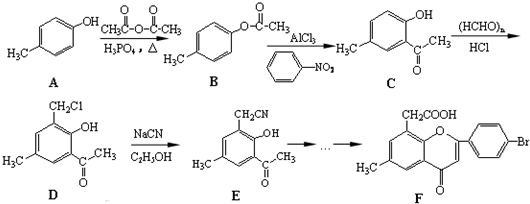
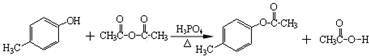
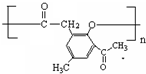
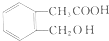
.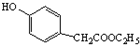 )是一种重要的医药中间体.写出以A和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
)是一种重要的医药中间体.写出以A和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选).合成路线流程图示例如下: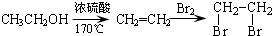
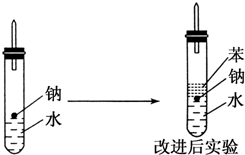 某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸 ②Na+水 ③Al+NaOH溶液.为分析上述三个反应生成的H2,他们设计了如下装置图.
某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸 ②Na+水 ③Al+NaOH溶液.为分析上述三个反应生成的H2,他们设计了如下装置图.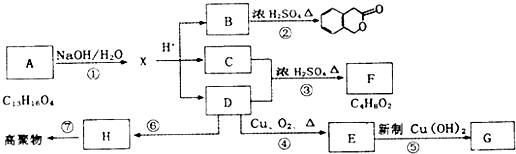
 ④
④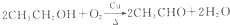 .
.