题目内容
11.(1)高炉炼铁过程中发生的主要反应为:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe (s)+CO2(g),已知该反应在不同温度下的平衡常数如表.| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
②在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.求CO的平衡转化率=60%.
(2)常温下,HR(酸)溶液pH=3,MOH(碱)的溶液pH=11,两者等体积混合后溶液显碱性.则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式M++H2O?MOH+H+
(3)25℃时,pH=0的HCl、0.1mol/L的HCl、0.01mol/L的NaOH、pH=14的NaOH四种溶液中由水电离产生的C(H+)水 之比为1:10:100:1.
(4)已知25℃时,电离常数Ka(HF)=3.6×10-4,则0.1mol•L-1 HF溶液中c(H+)=6×10-3mol•L-1
(5)在温度t℃时,pH=3的某水溶液中c(OH-)=10-8 mol/L.在此温度下5×10-5mol/LBa(OH)2溶液的pH=7.
分析 (1)①由表中数据可知,温度越高平衡常数越小,故升高温度平衡向逆反应移动,正反应为放热反应;
②令平衡时CO的物质的量变化为nmol,利用三段式表示出平衡时CO、CO2的物质的量,进而计算CO的浓度变化量,再利用转化率定义计算CO的转化率;
(2)根据酸中氢离子和碱中氢氧根离子的关系结合混合溶液的酸碱性确定碱的强弱,从而确定易水解的离子,根据水解方程式写出即可;
(3)电离平衡为H2O?H++OH-,在水中加入酸或者碱溶液,导致溶液中氢离子或者氢氧根离子浓度增大,抑制了水的电离;酸溶液中氢氧根离子是水电离的,碱溶液中氢离子是水电离,据此计算出各项水电离的氢离子浓度;
(4)已知25℃时,电离常数Ka(HF)=3.6×10-4,则0.1mol•L-1 HF溶液中HF?H++F-,Ka(HF)=$\frac{c({H}^{+})c({F}^{-})}{c(HF)}$,计算得到c(H+);
(5)在温度t℃时,pH=3的某水溶液中c(OH-)=10-8 mol/L,此温度下离子积常数Kw=10-3×10-8=10-11,据此计算氢氧化钡溶液中氢离子浓度得到溶液PH.
解答 解:(1)①由表中数据可知,温度越高平衡常数越小,故升高温度平衡向逆反应移动,正反应为放热反应,即△H<0,
故答案为:<;
②(2)令平衡时CO的物质的量变化为nmol,则:
$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)
开始(mol):1 1
变化(mol):n n
平衡(mol):1-n n+1
所以 $\frac{n+1}{1-n}$=4,解得n=0.6,
CO的平衡转化率为$\frac{0.6}{1}$×100%=60%,
故答案为:60%;
(2)酸中C(H+)=10-3 mol/L,碱中C(OH-)=10-3 mol/L,所以C(H+)=C(OH-)=10-3 mol/L,两者等体积混合后溶液显碱性,说明碱过量,即氢氧根离子浓度小于碱浓度,所以该碱是弱碱,溶液中水解的离子是该碱的阳离子,水解方程式为:M++H2O?MOH+H+,
故答案为:M++H2O?MOH+H+;
(3)酸溶液中,氢氧根离子是水电离,碱溶液中氢离子是水电离的,
①pH=0的盐酸,溶液中氢离子浓度为1mol/L,水电离的氢氧根离子为:$\frac{1×1{0}^{-14}}{1}$mol/L=1×10-14mol/L;
②0.1mol/L盐酸,溶液中氢离子浓度为0.1mol/L,水电离的氢氧根离子为:$\frac{1×1{0}^{-14}}{0.1}$mol/L=1×10-13mol/L;
③0.01mol/L的NaOH 溶液,溶液中氢离子浓度为:$\frac{1×1{0}^{-14}}{0.01}$mol/L=1×10-12mol/L;
④pH=14的NaOH 溶液,溶液中氢离子浓度为:1mol/L;
所以由水电离产生的c(H+)之比①:②:③:④=1×10-14mol/L:1×10-13mol/L:1×10-12mol/L:mol/L=1:10:100:1,
故答案为:1:10:100:1;
(4)已知25℃时,电离常数Ka(HF)=3.6×10-4,则0.1mol•L-1 HF溶液中HF?H++F-,Ka(HF)=$\frac{c({H}^{+})c({F}^{-})}{c(HF)}$,c(H+)=$\sqrt{Ka×c(HF)}$=$\sqrt{3.6×1{0}^{-4}×0.1}$
=6×10-3mol/L,
故答案为:6×10-3 ;
(5)在温度t℃时,pH=3的某水溶液中c(OH-)=10-8 mol/L,此温度下离子积常数Kw=10-3×10-8=10-11,在此温度下5×10-5mol/LBa(OH)2溶液中c(OH-)=1×10-4mol/L,溶液直至c(H+)=$\frac{1{0}^{-11}}{1×1{0}^{-4}}$=10-7mol/L,溶液的pH=7,
故答案为:7.
点评 本题考查了水的电离、离子积常数、平衡计算,题目难度中等,解题关键是合理判断酸碱溶液中水电离情况分析及计算方法,注意酸溶液中,氢氧根离子是水电离,碱溶液中氢离子是水电离的.

| A. | 分子晶体中一定存在共价键和范德华力 | |
| B. | 由非金属元素组成的化合物一定是共价化合物 | |
| C. | 原子晶体和分子晶体一定均含有共价键,离子晶体也可能含有共价键 | |
| D. | 两个非金属元素原子间不可能形成离子键 |
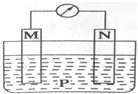 如图所示装置中,可观察到电流计指针偏转,M棒变粗,N棒变细.下表所列M、N、P物质中,可以组合成该装置的是( )
如图所示装置中,可观察到电流计指针偏转,M棒变粗,N棒变细.下表所列M、N、P物质中,可以组合成该装置的是( )| 选项号 | M | N | P |
| A | 铜 | 铁 | 稀盐酸 |
| B | 银 | 锌 | 硝酸银溶液 |
| C | 锌 | 铁 | 硝酸铁溶液 |
| D | 锌 | 铜 | 稀硫酸 |
| A. | A | B. | B | C. | C | D. | D |
Ⅰ.(1)我国化学家侯德榜改革国外的纯碱生产工艺,其生产流程可简要表示如图:
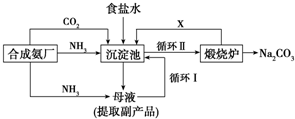
①往饱和食盐水中依次通入足量的NH3、CO2(氨碱法),而不先通CO2再通NH3的原因是由于CO2在NaCl溶液中的溶解度很小,NH3在水中溶解度较大,先通入NH3使食盐水呈碱性,能够吸收大量CO2气体,产生较高浓度的HCO3-,才能析出NaHCO3晶体.
②写出沉淀池中反应的化学方程式NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓.
Ⅱ.某实验小组探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.
(2)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊.A受热分解的化学方程式为2NaHCO3$\frac{\underline{\;加热\;}}{\;}$Na2CO3+CO2↑+H2O.
(3)称取两种固体各2g,分别加入两个小烧杯中,再各加10mL蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复到室温,向所得溶液中各滴入2滴酚酞溶液.
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论:相同温度下,Na2CO3比NaHCO3易溶于水.
②同学们在两烧杯中还观察到以下现象.其中,盛放Na2CO3的烧杯中出现的现象是b、d(填字母序号).
a.溶液温度下降
b.溶液温度升高
c.滴入酚酞后呈浅红色
d.滴入酚酞后呈红色
(4)同学们将两种固体分别配制成0.5mol•L-1的溶液,设计如表方案并对反应现象做出预测:
| 实验方案 | 预测现象 | 预测依据 |
| 操作1:向2mL Na2CO3溶液中滴加1mL 0.5mol•L-1 CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应:Ca2++CO32-═CaCO3↓ (离子方程式) |
| 操作2:向2mL NaHCO3溶液中滴加1mL 0.5mol•L-1CaCl2溶液 | 无白色沉淀 | NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应 |
| A. | 在反应中不一定所有元素的化合价都发生变化 | |
| B. | 化合反应和分解反应不可能是氧化还原反应 | |
| C. | 氧化还原反应中不一定要有氧气参与反应 | |
| D. | 工业上利用CO与Fe2O3作用炼铁的反应是氧化还原反应 |
| A. | NaOH | B. | H2SO4 | C. | AgNO3 | D. | Na2SO4 |
| A. | Q1<Q2 | |
| B. | 正交硫不如单斜硫稳定 | |
| C. | 正交硫具有的能量比单斜硫低 | |
| D. | 等质量的单斜硫和正交硫完全燃烧生成的二氧化硫一样多 |
 的同分异构体有3种.
的同分异构体有3种.