题目内容
19. 重铬酸钾(K2Cr2O7)是一种重要的氧化剂,可以检验司机是否酒后驾驶.Cr2O72-+3C2H5OH+16H+=41Cr(H2O)6]3++3CH3COOH
重铬酸钾(K2Cr2O7)是一种重要的氧化剂,可以检验司机是否酒后驾驶.Cr2O72-+3C2H5OH+16H+=41Cr(H2O)6]3++3CH3COOH(1)铬原子核外有6个未成对电子.1mol1Cr(H2O)6]3+中含有δ键的数目是18×6.02×1023.
(2)CH3COOH中C原子轨道杂化类型为sp3杂化、sp2杂化.
(3)CH3CH2OH与H2O可以任意比互溶,是因为H2O与乙醇分子间形成氢键,都为极性分子.
(4)C、O位于周期表中第二周期,请比较两者第一电离大小:C<O(填“>”或“<”)
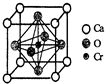
(5)Cr和Ca可以形成一种具有特殊导电性的复合氧化物,晶胞如图所示.该晶体的化学式为CaCrO3.
分析 (1)铬原子核外有24个电子,核外电子排布为1s22s22p63s23p63d54s1,据此判断未成对电子;[Cr(H2O)6]3+中每个水分中含有2个δ键,每个水分子与铬离子之间形成一个配位键也是δ键;
(2)CH3COOH中C原子分别形成4个、3个δ键,没有孤对电子;
(3)H2O与CH3CH3OH都含有氢键,且都为极性分子;
(4)同一周期元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素;
(5)利用均摊法计算该物质的化学式.
解答 解:(1)铬原子核外有24个电子,核外电子排布为1s22s22p63s23p63d54s1,所以未成对的电子数目为6个;[Cr(H2O)6]3+中每个水分中含有2个δ键,每个水分子与铬离子之间形成一个配位键也是δ键,所以1mol[Cr(H2O)6]3+中含有δ键的数目是18mol,即为18×6.02×1023,
故答案为:6;18×6.02×1023;
(2)CH3COOH中C原子分别形成4个、3个δ键,没有孤对电子,分别为sp3杂化、sp2杂化;
故答案为:sp3、sp2;
(3)H2O与CH3CH2OH都含有氢键,且都为极性分子,二者任意比例互溶;
故答案为:H2O与乙醇分子间形成氢键,都为极性分子;
(4)C、O元素处于同一周期且原子序数逐渐增大,所以第一电离能大小为:O>C;
故答案为:<;
(5)根据晶胞结构图和均摊法可知,晶胞中O原子数为$\frac{1}{2}$×6=3,Ca原子数为$\frac{1}{8}$×8=1,Cr原子数为1,则化学式为CaCrO3,故答案为:CaCrO3.
点评 本题考查较为综合,题目难度较大,涉及第一电离能的判断、电子排布式、杂化类型的判断、晶胞的计算等,注意利用均摊法计算晶胞的构成.

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案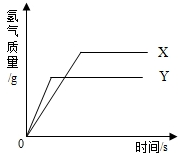 现有等质量的X、Y两种金属,分别放入溶质质量分数相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如右图所示(已知X、Y在生成物中化合价均为+2价).则下列说法中不正确的是( )
现有等质量的X、Y两种金属,分别放入溶质质量分数相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如右图所示(已知X、Y在生成物中化合价均为+2价).则下列说法中不正确的是( )| A. | 生成氢气的质量:X>Y | B. | 相对原子质量:X>Y | ||
| C. | 金属活动性:Y>X | D. | 消耗硫酸的质量:X>Y |
| A. | 开发太阳能、水能、风能、可燃冰等新能源,减少使用煤、石油等化石燃料 | |
| B. | 将煤进行气化处理,提高煤的综合利用效率 | |
| C. | 研究采煤、采油新技术,提高产量以满足工业生产的快速发展 | |
| D. | 实现资源的“3R”利用观,即:减少资源消耗、增加资源的重复使用、资源的循环再生 |
| A. | “碘盐”宜密封保存 | |
| B. | “碘盐”就是“I2+NaCl” | |
| C. | 使用“碘盐”时不宜高温煎炒 | |
| D. | 食用加碘盐,以确保人体对碘的摄入量 |
| A. | 金属钠着火,可用泡沫灭火器扑灭 | |
| B. | 用10 mL量筒准确量取7.50 mL稀硫酸 | |
| C. | 用四氯化碳萃取溴水中的溴时,将溴的四氯化碳溶液从分液漏斗下口放出 | |
| D. | 在氢气还原氧化铜实验中,先加热氧化铜,后通入氢气 |
| A. | 根据氧化物的性质可将氧化物分成酸性氧化物、碱性氧化物、两性氧化物和特殊氧化物等 | |
| B. | 根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应 | |
| C. | 根据分散质粒子直径大小可将液体分散系分为溶液、胶体和浊液 | |
| D. | 根据电解质的水溶液导电能力的强弱将电解质分为强电解质和弱电解质 |