题目内容
4.准确称取12g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有500mL某浓度盐酸溶液的烧杯中,充分反应后过滤,向滤液中加入10mol•L-1的NaOH溶液,产生的沉淀质量m与加入的NaOH溶液的体积V的关系如图所示:请填空回答:(1)HCl溶液的物质的量浓度为1.4mol/L.
(2)若a=4.3,用于沉淀Fe3+消耗NaOH的体积是5.7mL,铝土矿中各成分:Al2O3质量为10.2 g,SiO2质量分数为2.3%.
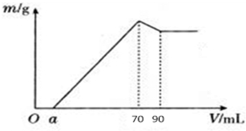
分析 (1)加入70mL氢氧化钠溶液时,沉淀量最大,此时溶液中溶质为氯化钠,根据钠离子守恒计算氢化钠的物质的量,根据钠元素、氯离子守恒有n(HCl)=n(NaCl)=n(NaOH),再根据c=V$\frac{n}{V}$计算;
(2)从70mL~90mL加入的10mL氢氧化钠完全溶解氢氧化铝,根据n=cV计算该阶段消耗的n(NaOH),再根据方程式计算氢氧化铝的物质的量,利用铝元素守恒计算溶液中n(Al3+),进而计算铝离子完全沉淀消耗的氢氧化钠的物质的量,根据n=cV计算铁离子、铝离子完全消耗的n(NaOH),进而计算n(Fe3+),利用铁元素守恒计算n(Fe2O3),根据m=nM计算氧化铁的质量,根据质量分数定义计算;
解答 解:(1)当加入NaOH溶液的体积为70ml时,n(NaOH)=0.07L×10mol/L=0.7mol,
此时沉淀的质量达到最大值,则此时溶液的溶质只有NaCl,
根据Na元素守恒有n(NaCl)=n(NaOH)=0.7mol,
n(HCl)=n(NaCl)=n(NaOH)=0.7mol,
所以原盐酸溶液中c(HCl)=$\frac{0.7mol}{0.5L}$=1.75mol/L,
故答案为:1.4mol/L;
(2)从70mL~90mL加入的20mL氢氧化钠完全溶解氢氧化铝,该阶段消耗的n(NaOH)=0.02L×10mol/L=0.2mol,根据方程式Al(OH)3+NaOH=NaAlO2+2H2O可知,n[Al(OH)3]=0.2mol,故溶液中n(Al3+)=0.2mol,根据Al元素守恒可知n(Al2O3)=0.1mol,则m(Al2O3)=0.1mol×102g/mol=10.2g;
铝离子完全沉淀消耗氢氧化钠的物质的量为0.2mol×3=0.6mol,铁离子、铝离子完全沉淀消耗的氢氧化钠溶液的体积为70mL-4.3mL=65.7mL,故该阶段消耗n(NaOH)=0.0657L×10mol/L=0.657mol,故铁离子完全沉淀消耗的氢氧化钠的物质的量为0.657mol-0.6mol=0.057mol,
则铁离子完全沉淀消耗的氢氧化钠的体积为V=$\frac{0.057mol}{10mol/L}$=0.0057L=52.7ml,
故n(Fe3+)=$\frac{0.057mol}{3}$=0.019mol,故m(Fe2O3)=0.019mol×$\frac{1}{2}$×160g/mol=1.52g,m(SiO2)=12-10.2g-1.52g=0.28g;
SiO2为$\frac{0.28g}{12g}×100%$=2.3%.
故答案为:5.7;10.2 g;2.3%.
点评 本题考查化学计算,涉及方程式的计算、混合物的计算、图象计算等,难度中等,清楚图象各段反应是解题的关键.

| A. | 水的汽化 | B. | NaOH熔化 | C. | HCl气体溶于水 | D. | 水的电解 |
| 选项 | 实验事实 | 理论解释( ) |
| A | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
| B | CO2为直线形分子 | CO2分子中C═O是极性键 |
| C | H2O的稳定性大于H2S | H2O分子间有氢键 |
| D | HF的沸点高于HCl | HF的相对分子质量小于HCl |
| A. | A | B. | B | C. | C | D. | D |
| A. | 外界条件不能改变平衡状态 | B. | 达平衡时正、逆反应速率相等 | ||
| C. | 各组分的含量不随时间而变化 | D. | 是动态平衡 |
| A. | 2.24 L CH4气体中含有的电子数为NA | |
| B. | 25℃时,1.0 L pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| C. | 0.1NA个氯气分子溶于水形成1 L溶液,所得溶液中c(Cl-)=0.1 mol/L | |
| D. | 1 mol CH3COONa和少量CH3COOH溶于水形成的中性溶液中,CH3COO-数目为NA |
②NaH+H2O=NaOH+H2↑
③2Na+2H2O=2NaOH+H2↑,
④2F2+2H2O=4HF+O2
有关上述反应叙述不正确的是( )
| A. | 离子半径:N3->F->Na+ | |
| B. | 上述反应除①外都是氧化还原反应 | |
| C. | 反应②③中的水做氧化剂,每生成1mol H2,转移的电子数为2NA | |
| D. | 反④中的水是还原剂 |
| 实验编号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属质量/g | 9.0 | 4.8 | 0 | 0 |
| NO体积/L | 1.12 | 2.24 | 3.36 | V |
(1)硝酸的浓度为多少?
(2)③中溶解的Cu的质量为多少?
(3)④中的V为多少?
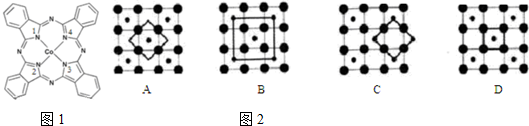
 ),在该晶体中与一个钴原子等距离且最近的钴原子有12个;筑波材料科学国家实验室一个科研小组发现了在 5K 下呈现超导性的晶体,该晶体具有CoO2的层状结构(如2所示,小球表示Co原子,大球表示O原子).下列用粗线画出的重复结构单元示意图不能描述CoO2的化学组成的是D.
),在该晶体中与一个钴原子等距离且最近的钴原子有12个;筑波材料科学国家实验室一个科研小组发现了在 5K 下呈现超导性的晶体,该晶体具有CoO2的层状结构(如2所示,小球表示Co原子,大球表示O原子).下列用粗线画出的重复结构单元示意图不能描述CoO2的化学组成的是D. 重铬酸钾(K2Cr2O7)是一种重要的氧化剂,可以检验司机是否酒后驾驶.Cr2O72-+3C2H5OH+16H+=41Cr(H2O)6]3++3CH3COOH
重铬酸钾(K2Cr2O7)是一种重要的氧化剂,可以检验司机是否酒后驾驶.Cr2O72-+3C2H5OH+16H+=41Cr(H2O)6]3++3CH3COOH