题目内容
图1为两套实验装置
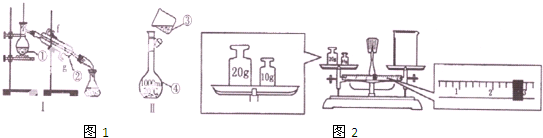
(1)写出标号为①的仪器的名称: .
(2)若利用装置Ⅰ制取蒸馏水,还缺少的仪器有 .
(3)现需要0.1mol?L-1的Na2CO3溶液480mL,在配制该溶液时应称量NaCO3固体的质量是 g,装置Ⅱ是某同学配制此溶液时转移操作的示意图,图中有两处错误分别是 , .
(4)某同学欲称量一定量的Na2CO3固体,他先用托盘称量烧杯的质量,天平平衡后的状如图2,则烧杯的实际质量为 g.
(5)配制溶液时,一般可以分为以下几个步骤:①称量②计算③溶解④颠倒摇匀⑤转移⑥洗涤⑦定容⑧冷却
其正确的顺序为 .
(6)在配制过程中,如果其他操作都是正确的,下列操作会引起浓度偏高的是 .
①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量溶液洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤定容摇匀后发现溶液体积低于刻度线,在补加少量蒸馏水至刻度线.

(1)写出标号为①的仪器的名称:
(2)若利用装置Ⅰ制取蒸馏水,还缺少的仪器有
(3)现需要0.1mol?L-1的Na2CO3溶液480mL,在配制该溶液时应称量NaCO3固体的质量是
(4)某同学欲称量一定量的Na2CO3固体,他先用托盘称量烧杯的质量,天平平衡后的状如图2,则烧杯的实际质量为
(5)配制溶液时,一般可以分为以下几个步骤:①称量②计算③溶解④颠倒摇匀⑤转移⑥洗涤⑦定容⑧冷却
其正确的顺序为
(6)在配制过程中,如果其他操作都是正确的,下列操作会引起浓度偏高的是
①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量溶液洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤定容摇匀后发现溶液体积低于刻度线,在补加少量蒸馏水至刻度线.
考点:配制一定物质的量浓度的溶液
专题:实验题
分析:(1)熟悉常见仪器,了解它们的名称;
(2)蒸馏装置中的主要仪器有蒸馏烧瓶、冷凝管、牛角管、锥形瓶,酒精灯据此解答;
(3)依据所配溶液的体积选择合适的容量瓶,依据n=C×V、m=n×M计算所需碳酸钠的质量;容量瓶规格选择不合适;倾倒溶液应用玻璃棒引流;
(4)根据天平的使用方法是左物右码,左盘的质量等于右盘的质量加游码的质量,即物品质量=砝码质量+游码质量;
(5)依据配制一定物质的量浓度溶液时的一般步骤解答;
(6)根据c=
进行误差分析,凡是引起n偏小或者V偏大的操作,所配溶液的浓度将会偏小;凡是引起n偏大或者V偏小的操作,所配溶液的浓度将会偏大.
(2)蒸馏装置中的主要仪器有蒸馏烧瓶、冷凝管、牛角管、锥形瓶,酒精灯据此解答;
(3)依据所配溶液的体积选择合适的容量瓶,依据n=C×V、m=n×M计算所需碳酸钠的质量;容量瓶规格选择不合适;倾倒溶液应用玻璃棒引流;
(4)根据天平的使用方法是左物右码,左盘的质量等于右盘的质量加游码的质量,即物品质量=砝码质量+游码质量;
(5)依据配制一定物质的量浓度溶液时的一般步骤解答;
(6)根据c=
| n |
| V |
解答:
解:(1)标号为①的仪器的名称是蒸馏烧瓶,故答案为:蒸馏烧瓶;
(2)制取蒸馏水,需要用酒精灯加热,故答案为:酒精灯;
(3)配置0.1mol?L-1的Na2CO3溶液500mL则需要碳酸钠的物质的量为n=0.1mol?L-1×0.5L=0.05mol,其质量为m=n×M=0.05mol×106g/mol=5.3g;应选用500ml的容量瓶,倾倒溶液应用玻璃棒引流;
故答案为:5.3;未用玻璃棒引流;未采用500ml容量瓶;
(4)物品质量=砝码质量+游码质量=27+0.4=27.4g;
故答案为:27.4;
(5)配制一定物质的量浓度的溶液步骤为:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,所以正确的操作顺序为:②①③⑧⑤⑥⑦④;
故答案为:②①③⑧⑤⑥⑦④;
(6)①没有洗涤烧杯和玻璃棒,溶质的质量减小,n偏小,浓度偏小,故①错误;
②转移溶液时不慎有少量溶液洒到容量瓶外面,溶质的质量减小,n偏小,浓度偏小,故②错误;
③容量瓶不干燥,含有少量蒸馏水,对溶质的物质的量和最终溶液的体积都没有影响,不会影响配制结果,故③错误;
④定容时俯视刻度线,导致加入的蒸馏水低于容量瓶刻度线,配制的溶液体积偏小,溶液的浓度偏高,故④正确;
⑤定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线,导致配制的溶液体积偏大,配制的溶液浓度偏低,故⑤错误;
故答案为:④.
(2)制取蒸馏水,需要用酒精灯加热,故答案为:酒精灯;
(3)配置0.1mol?L-1的Na2CO3溶液500mL则需要碳酸钠的物质的量为n=0.1mol?L-1×0.5L=0.05mol,其质量为m=n×M=0.05mol×106g/mol=5.3g;应选用500ml的容量瓶,倾倒溶液应用玻璃棒引流;
故答案为:5.3;未用玻璃棒引流;未采用500ml容量瓶;
(4)物品质量=砝码质量+游码质量=27+0.4=27.4g;
故答案为:27.4;
(5)配制一定物质的量浓度的溶液步骤为:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,所以正确的操作顺序为:②①③⑧⑤⑥⑦④;
故答案为:②①③⑧⑤⑥⑦④;
(6)①没有洗涤烧杯和玻璃棒,溶质的质量减小,n偏小,浓度偏小,故①错误;
②转移溶液时不慎有少量溶液洒到容量瓶外面,溶质的质量减小,n偏小,浓度偏小,故②错误;
③容量瓶不干燥,含有少量蒸馏水,对溶质的物质的量和最终溶液的体积都没有影响,不会影响配制结果,故③错误;
④定容时俯视刻度线,导致加入的蒸馏水低于容量瓶刻度线,配制的溶液体积偏小,溶液的浓度偏高,故④正确;
⑤定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线,导致配制的溶液体积偏大,配制的溶液浓度偏低,故⑤错误;
故答案为:④.
点评:本题考查学生化学实验的基本操作知识,熟悉配置一定物质的量浓度溶液的原理和操作步骤及常见仪器的使用方法是解题关键,注意容量瓶规格的选择.

练习册系列答案
相关题目
下列的方程式正确的是( )
| A、K2C2O4溶液的电离方程式:K2C2O4?2K++C2O42- |
| B、制备乙酸乙酯时将产生的蒸气导入饱和碳酸钠溶液:CO32ˉ+2H+=CO2↑+H2O |
| C、氯化镁溶液中通入二氧化碳:Mg2++CO2+H2O═MgCO3↓+2H+ |
| D、将等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
下列有关实验的叙述正确的是( )
| A、浓硝酸可保存在带橡皮塞的棕色细口瓶中 |
| B、用pH试纸测定溶液pH时,pH试纸应事先润湿 |
| C、配制一定物质的量浓度的溶液时,选用的容量瓶规格由需配制的溶液体积决定 |
| D、中和滴定时,为了使滴定终点溶液颜色变化明显,可多滴几滴指示剂 |
 某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
 (1)现有以下物质:
(1)现有以下物质: