题目内容
如图所示图象中,纵坐标为沉淀物的物质的量,横坐标为某溶液中加入反应物的物质的量,按试题将相应图的字母填入下列空格中,并写出所发生反应的离子方程式.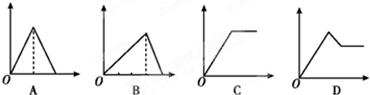
(1)表示向饱和AlCl3溶液中滴加氨水至过量的是 ,离子方程式: .
(2)表示向饱和AlCl3溶液中滴加NaOH溶液至过量的是 ,离子方程式: .
(3)表示向饱和石灰水中通入CO2至过量的是 ,离子方程式: .
(4)表示向MgCl2和AlCl3的混合溶液中滴加NaOH溶液至过量的是 .离子方程式: .

(1)表示向饱和AlCl3溶液中滴加氨水至过量的是
(2)表示向饱和AlCl3溶液中滴加NaOH溶液至过量的是
(3)表示向饱和石灰水中通入CO2至过量的是
(4)表示向MgCl2和AlCl3的混合溶液中滴加NaOH溶液至过量的是
考点:离子方程式的书写,镁、铝的重要化合物
专题:离子反应专题
分析:(1)饱和AlCl3溶液中滴入稀氨水生成沉淀氢氧化铝,氢氧化铝不溶于弱碱氨水;
(2)饱和AlCl3溶液中滴加NaOH溶液,生成氢氧化铝沉淀,氢氧化铝能够与氢氧化钠溶液反应而溶解;
(3)氢氧化钙通入二氧化碳,先反应生成碳酸钙沉淀,然后碳酸钙与二氧化碳和水反应生成碳酸氢钙而溶解;
(4)MgCl2和AlCl3混合溶液中滴加NaOH溶液,生成两种沉淀:氢氧化镁和氢氧化铝,随着反应的进行沉淀量增大,但氢氧化铝溶于强碱,氯化镁和氯化铝完全转化为氢氧化物沉淀时,再继续加入氢氧化钠溶液,沉淀会部分溶解.
(2)饱和AlCl3溶液中滴加NaOH溶液,生成氢氧化铝沉淀,氢氧化铝能够与氢氧化钠溶液反应而溶解;
(3)氢氧化钙通入二氧化碳,先反应生成碳酸钙沉淀,然后碳酸钙与二氧化碳和水反应生成碳酸氢钙而溶解;
(4)MgCl2和AlCl3混合溶液中滴加NaOH溶液,生成两种沉淀:氢氧化镁和氢氧化铝,随着反应的进行沉淀量增大,但氢氧化铝溶于强碱,氯化镁和氯化铝完全转化为氢氧化物沉淀时,再继续加入氢氧化钠溶液,沉淀会部分溶解.
解答:
解:(1)向饱和AlCl3溶液中滴加氨水至过量,发生反应的离子方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,一水合氨属于弱碱,氢氧化铝不溶于弱碱,所以沉淀的质量不变,图象C符合该过程;
故答案为:C;Al3++3NH3?H2O=Al(OH)3↓+3NH4+;
(2)饱和AlCl3溶液中滴加NaOH溶液,首先发生反应:Al3++3OH-═Al(OH)3↓,生成氢氧化铝沉淀,后发生Al(OH)3+OH-═AlO2-+2H2O,沉淀溶解,根据方程式可知:1molAlCl3反应,生成沉淀和沉淀溶解,消耗的NaOH的物质的量分别为3mol和1mol,图象B符合该过程;
故答案为:B;Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O;
(3)饱和石灰水通过量CO2气体,首先发生反应生成碳酸钙:Ca2++2OH-+CO2=CaCO3↓+H2O,然后碳酸钙与二氧化碳反应,沉淀溶解:CaCO3+CO2+H2O=Ca2++2HCO3-,生成沉淀和沉淀溶解所用CO2相等,图象A符合该过程;
故答案为:A;Ca2++2OH-+CO2=CaCO3↓+H2O、CaCO3+CO2+H2O=Ca2++2HCO3-;
(4)MgCl2和AlCl3混合溶液中滴加NaOH溶液,发生反应:Al3++3OH-═Al(OH)3↓、Mg2++2OH-═Mg(OH)2↓生成两种沉淀,沉淀量随着氢氧化钠的量增大而增大,但氯化镁和氯化铝完全转化为氢氧化物沉淀时,再继续加入氢氧化钠溶液,然后发生 Al(OH)3+OH-═AlO2-+2H2O,随着氢氧化钠溶液的加入,沉淀量减少,但不会完全溶解,图象D符合该过程;
故答案为:D;Al3++3OH-═Al(OH)3↓、Mg2++2OH-═Mg(OH)2↓、Al(OH)3+OH-═AlO2-+2H2O.
故答案为:C;Al3++3NH3?H2O=Al(OH)3↓+3NH4+;
(2)饱和AlCl3溶液中滴加NaOH溶液,首先发生反应:Al3++3OH-═Al(OH)3↓,生成氢氧化铝沉淀,后发生Al(OH)3+OH-═AlO2-+2H2O,沉淀溶解,根据方程式可知:1molAlCl3反应,生成沉淀和沉淀溶解,消耗的NaOH的物质的量分别为3mol和1mol,图象B符合该过程;
故答案为:B;Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O;
(3)饱和石灰水通过量CO2气体,首先发生反应生成碳酸钙:Ca2++2OH-+CO2=CaCO3↓+H2O,然后碳酸钙与二氧化碳反应,沉淀溶解:CaCO3+CO2+H2O=Ca2++2HCO3-,生成沉淀和沉淀溶解所用CO2相等,图象A符合该过程;
故答案为:A;Ca2++2OH-+CO2=CaCO3↓+H2O、CaCO3+CO2+H2O=Ca2++2HCO3-;
(4)MgCl2和AlCl3混合溶液中滴加NaOH溶液,发生反应:Al3++3OH-═Al(OH)3↓、Mg2++2OH-═Mg(OH)2↓生成两种沉淀,沉淀量随着氢氧化钠的量增大而增大,但氯化镁和氯化铝完全转化为氢氧化物沉淀时,再继续加入氢氧化钠溶液,然后发生 Al(OH)3+OH-═AlO2-+2H2O,随着氢氧化钠溶液的加入,沉淀量减少,但不会完全溶解,图象D符合该过程;
故答案为:D;Al3++3OH-═Al(OH)3↓、Mg2++2OH-═Mg(OH)2↓、Al(OH)3+OH-═AlO2-+2H2O.
点评:本题考查了离子方程式的书写,熟悉反应的实质,明确图象的含义是解题关键,题目难度不大.

练习册系列答案
相关题目
化学知识在生活中有重要意义,下列说法不正确的是( )
| A、在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 |
| B、乙醇、乙酸和甲醛广泛应用于食品加工 |
| C、计算机芯片所用的材料是高纯度的二氧化硅 |
| D、捕获工业排放的CO2能降低地球的温室效应 |
下列说法正确的是( )
A、
| ||||||||||
| B、11.7g食盐晶体中的分子数为0.2×6.02×10-23 | ||||||||||
| C、等量的白磷蒸气和白磷固体分别完全燃烧,后者放出热量多 | ||||||||||
| D、根据分散系的稳定性大小将混合物分为胶体、溶液和浊液 |
 (1)材料是人类赖以生存和发展的重要物质基础.
(1)材料是人类赖以生存和发展的重要物质基础.