题目内容
甲烷作为一种新能在化学领域应用广泛,请回答下列问题.
高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+260kJ?mol-1已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ?mol-1.则CH4与O2反应生成CO和H2的热化学方程式为 .
高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+260kJ?mol-1已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ?mol-1.则CH4与O2反应生成CO和H2的热化学方程式为
考点:用盖斯定律进行有关反应热的计算
专题:
分析:热化学方程式要标明物质的聚集状态,并且焓变的符号和单位要正确,依据热化学方程式和盖斯定律含义计算,将方程式CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=260kJ?mol-1①;
2CO(g)+O2(g)═2CO2(g)△H=-566kJ?mol-1②,
2×①+②得CH4与O2反应生成CO和H2的热化学方程式.
2CO(g)+O2(g)═2CO2(g)△H=-566kJ?mol-1②,
2×①+②得CH4与O2反应生成CO和H2的热化学方程式.
解答:
解:CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+260kJ?mol-1①;
2CO(g)+O2(g)═2CO2(g)△H=-566kJ?mol-1②,
将方程式2×①+②得:2CH4(g)+O2(g)═2CO(g)+4H2(g)△H=+46kJ?mol-1 ,
故答案为:2CH4(g)+O2(g)═2CO(g)+4H2(g)△H=+46kJ?mol-1 .
2CO(g)+O2(g)═2CO2(g)△H=-566kJ?mol-1②,
将方程式2×①+②得:2CH4(g)+O2(g)═2CO(g)+4H2(g)△H=+46kJ?mol-1 ,
故答案为:2CH4(g)+O2(g)═2CO(g)+4H2(g)△H=+46kJ?mol-1 .
点评:本题主要考查了热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比,掌握热化学方程式的意义和盖斯定律的计算应用是解题关键,题目难度不大.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
实验室里进行过滤和蒸发操作时,都要用到的仪器是( )
| A、烧杯 | B、玻璃棒 |
| C、蒸发皿 | D、温度计 |
在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)═Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表,下列说法正确的是( )
| 温度/℃ | 25 | 80 | 230 |
| 平衡常数 | 5×104 | 2 | 1.9×10-5 |
| A、上述生成Ni(CO)4的反应为吸热反应 |
| B、25℃时,反应Ni(CO)4(g)═Ni(s)+4CO(g)的平衡常数为2×10-5 |
| C、80℃达到平衡时,测得n(CO)=0.3mol,则Ni(CO)4的平衡浓度为2 mol?L-1 |
| D、80℃时,测得某时刻Ni(CO)4、CO的浓度均为0.5 mol?L-1,则此时υ(正)>υ(逆) |
下列关于电解池的叙述中,不正确的是( )
| A、在电解池的阳极发生氧化反应 |
| B、与电源负极相接的是电解池的阴极 |
| C、电子从电源的负极沿导线流向电解池的阴极 |
| D、与电源正极相接的是电解池的阴极 |
制备硅单质时,主要化学反应如下:
①SiO2+2C
Si+2CO↑
②Si+2Cl2
SiCl4
③SiCl4+2H2
Si+4HCl
下列对上述三个反应的叙述中,不正确的是( )
①SiO2+2C
| ||
②Si+2Cl2
| ||
③SiCl4+2H2
| ||
下列对上述三个反应的叙述中,不正确的是( )
| A、①③为置换反应 |
| B、①②③均为氧化还原反应 |
| C、①②③均为非离子反应 |
| D、三个反应中硅元素均被还原 |
如图是四种常见有机物的比例模型示意图.下列说法正确的是( )
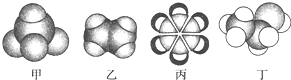

| A、甲能使酸性KMnO4溶液褪色 |
| B、乙可与溴水发生取代反应而使溴水褪色 |
| C、丙中的碳碳键是介于碳碳单键和碳碳双键之间的独特键 |
| D、丁在稀硫酸作用下可与乙酸发生取代反应 |