题目内容
在某温度下,把1.0mol NH3溶于水中配成1L溶液,测得溶液中OH-浓度和时间的图象如下:
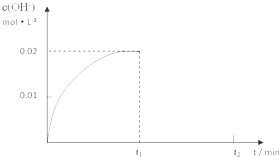
①求该温度时,氨水的电离平衡常数K(写出计算过程,结果保留三位有效数字)
②在t1时刻时再加入H2O配成2L溶液,在t2时刻时重新达到平衡,请在坐标系中画出t1~t2时间内OH-浓度随时间变化的曲线.
③将a mol/L的盐酸和b mol/L氨水等体积混合,所得溶液呈中性(忽略混合前后溶液体积的变化),则混合后溶液中:c(NH3?H2O)= .(用含有a、b的式子表示)

①求该温度时,氨水的电离平衡常数K(写出计算过程,结果保留三位有效数字)
②在t1时刻时再加入H2O配成2L溶液,在t2时刻时重新达到平衡,请在坐标系中画出t1~t2时间内OH-浓度随时间变化的曲线.
③将a mol/L的盐酸和b mol/L氨水等体积混合,所得溶液呈中性(忽略混合前后溶液体积的变化),则混合后溶液中:c(NH3?H2O)=
考点:酸碱混合时的定性判断及有关ph的计算,弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:①由图可知OH-平衡浓度为0.02mol/L,NH3?H2O起始浓度为1.0mol/L,依据电离平衡常数概念列式计算;
②在t1时刻再加入H2O配成2L溶液,加水稀释氢氧根离子浓度减小,一水合氨是弱电解质存在电离平衡,促进电离氢氧根离子略增加,于t2时刻重新达到平衡氢氧根离子浓度减小;
③将a mol?L-1的盐酸与b mol?L-1的氨水等体积混合,反应后溶液显中性,溶液中c(OH-)=1×10-7mol/L,根据K=
计算.
②在t1时刻再加入H2O配成2L溶液,加水稀释氢氧根离子浓度减小,一水合氨是弱电解质存在电离平衡,促进电离氢氧根离子略增加,于t2时刻重新达到平衡氢氧根离子浓度减小;
③将a mol?L-1的盐酸与b mol?L-1的氨水等体积混合,反应后溶液显中性,溶液中c(OH-)=1×10-7mol/L,根据K=
| c(NH4+)c(OH-) |
| c(NH3?H2O) |
解答:
解:①在某温度下,把1.00mol NH3溶于水中配成1.00L溶液,测得溶液中OH-浓度和时间的图象中平衡状态下氢氧根离子浓度为0.02mol/L;
平衡常数K=
=
=4.00×10-4;
答:氨水的电离平衡常数K=4.00×10-4;
②在t1时刻再加入H2O配成2L溶液,加水稀释氢氧根离子浓度减小,一水合氨是弱电解质存在电离平衡,促进电离氢氧根离子略增加,于t2时刻重新达到平衡氢氧根离子浓度减小,加入稀释,电离平衡常数不变,达到平衡时
=
=4.00×10-4,x=0.014mol/L,
画出的图象为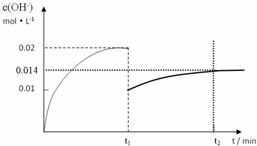 ,答:t1~t2时间内OH-浓度随时间变化的曲线为
,答:t1~t2时间内OH-浓度随时间变化的曲线为 ;
;
③求混合后溶液中剩余氨水浓度设为C,依据平衡常数概念计算,将a mol?L-1的盐酸与b mol?L-1的氨水等体积混合,反应后溶液显中性,溶液中c(OH-)=1×10-7mol/L,c(NH4+)=c(Cl-)=
mol/L,c=
mol/L-
mol/L=
mol/L,故答案为:
mol/L.
平衡常数K=
| c(NH4+)c(OH-) |
| c(NH3?H2O) |
| 0.02mol/L×0.02mol/L |
| 1mol/L-0.02mol/L |
答:氨水的电离平衡常数K=4.00×10-4;
②在t1时刻再加入H2O配成2L溶液,加水稀释氢氧根离子浓度减小,一水合氨是弱电解质存在电离平衡,促进电离氢氧根离子略增加,于t2时刻重新达到平衡氢氧根离子浓度减小,加入稀释,电离平衡常数不变,达到平衡时
| c(NH4+)c(OH-) |
| c(NH3?H2O) |
| x2 |
| 0.5mol/L-x |
画出的图象为
 ,答:t1~t2时间内OH-浓度随时间变化的曲线为
,答:t1~t2时间内OH-浓度随时间变化的曲线为 ;
;③求混合后溶液中剩余氨水浓度设为C,依据平衡常数概念计算,将a mol?L-1的盐酸与b mol?L-1的氨水等体积混合,反应后溶液显中性,溶液中c(OH-)=1×10-7mol/L,c(NH4+)=c(Cl-)=
| b |
| 2 |
| a |
| 2 |
| b |
| 2 |
| a-b |
| 2 |
| a-b |
| 2 |
点评:本题考查酸碱混合的定性判断和计算,侧重于学生的分析能力和计算能力的考查,注意把握计算公式的运用,难度不大.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
一定温度下可逆反应:A(s)+2B(g)?2C(g)+D(g);△H>0.现将1molA和2molB加入甲容器中,将4molC和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动).下列说法正确的是( )


| A、保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的度的2倍 |
| B、保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增加 |
| C、保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 |
| D、保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
25℃时,几种弱酸的电离常数如下:弱酸的化学式CH3COOH、HCN、H2S电离常数(25℃)1.8×10-5 4.9×10-10 K1=1.3×10-7 K2=7.1×10-15 25℃时,下列说法正确的是( )
| A、等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN) |
| B、a mol/LHCN溶液与b mol/LNaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定大于b |
| C、NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) |
| D、某浓度的NaCN溶液的pH=d,则其中由水电离出的c(H+)=10-dmol/L |
 如图为实验室制备乙烯的装置图,请回答:
如图为实验室制备乙烯的装置图,请回答: