题目内容
12.下列说法不正确的是( )| A. | 乙烯在空气中燃烧时有黑烟,因此可以用燃烧法区别甲烷和乙烯 | |
| B. | 苯与浓硝酸在浓硫酸存在条件下加热发生取代反应 | |
| C. | 蛋白质溶液中加入饱和硫酸铵溶液,蛋白质发生变性 | |
| D. | 氨基酸能够以不同数目和顺序相结合形成结构复杂的多肽 |
分析 A.甲烷和乙烯燃烧的现象不同;
B.苯在浓硫酸作用下可发生硝化反应;
C.蛋白质在硫酸铵溶液中发生盐析;
D.氨基酸可形成多肽化合物.
解答 解:A.甲烷和乙烯的含碳量不同,燃烧的现象不同,故A正确;
B.苯在浓硫酸作用下可发生硝化反应,也为取代反应,故B正确;
C.蛋白质在硫酸铵溶液中发生盐析,没有发生变性,故C错误;
D.氨基酸发生缩聚反应,可形成多肽化合物,故D正确.
故选C.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意把握相关有机物的结构和官能团的性质,难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
3.下列实验环节错误的是( )
| A. | 块状固体药品的取用:一横、二放、三慢竖 | |
| B. | 液体药品的倾倒:瓶塞倒放、紧挨瓶口、缓慢倒入 | |
| C. | 分液的操作:静置分层后将分液漏斗中下层液从下口放出,再将上层液从上口倒出 | |
| D. | 冷凝管的使用:冷却水下口进,上口出 |
20.在密闭容器中进行反应:X(g)+3Y(g)?2Z(g),下列说法正确的是( )
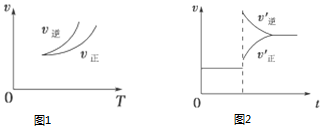

| A. | 图1说明正反应为吸热反应 | |
| B. | 反应达平衡后,增大压强气体密度将减小 | |
| C. | 图2可表示升高温度使平衡向逆反应方向移动 | |
| D. | 图2虚线可表示使用催化剂后引发的反应速率变化 |
7.Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2的反应类型是( )
| A. | 化合反应 | B. | 置换反应 | C. | 氧化还原反应 | D. | 复分解反应 |
17.某无色气体可能由CH4、NO2、NH3、H2、CO、CO2和HCl中的几种气体混合而成.在恒温恒压下,将此混合气体通过过量的澄清石灰水,未见石灰水变浑浊,但混合气体的总体积减小;将剩余气体导出后,在氧气中能点燃,燃烧产物不能使无水CuSO4粉末变蓝色,则原混合气体( )
| A. | 一定不含CH4和H2,可能含有NO2和NH3 | |
| B. | 一定含有CO,可能含HCl和CO2 | |
| C. | 只含有CO和HCl | |
| D. | 一定含CO和HCl,可能含CO2 |
13.今年,雾霾阴影笼罩全国.二氧化硫、氮氧化物和可吸入颗粒物是雾霾的主要组成成分,综合治理其污染是环境化学当前的重要研究内容.
(1)汽车尾气中的 NO(g)和CO(g)在一定温度和催化剂的条件下可净化.发生的反应如下:2NO(g)+2CO(g)═2CO2 (g)+N2(g)
①已知:N2(g)+O2 (g)═2NO(g)△H=+180.0kJ/mol.部分化学键的键能如下(键能指气态原子形成1mol化学键释放的最小能量)
则反应:2NO(g)+2CO(g)═2CO2 (g)+N2 (g)△H=-751.0 kJ/mol
②若上述反应在绝热、恒容的密闭体系中进行,并在t1时刻达到平衡状态,则下列示意图1不符合题意的是C(填选项序号).(图中ω、M、v正 分别表示质量分数、混合气体平均相对分子质量、正反应速率)

(2)尾气中的SO2可先催化氧化生成SO3,再合成硫酸.已知:2SO2(g)+O2(g)═2SO3(g)△H=-196.0kJ/mol.
①在一定温度的密闭容器中,SO2的转化率随时间的变化关系如图2所示:
则A点的v逆(SO2 )小于(填大于、小于或等于)B点的 v正(SO2).
②在某温度时,向10L的密闭容器中加入4.0molSO2和10.0molO2,反应达到平衡,改变下列条件,再次达到平衡时,能使O2的新平衡浓度和原来平衡浓度相同的是BC(填选项序号).
A.在其他条件不变时,减小容器的容积
B.保持温度和容器内压强不变,再充入2.0mol SO2和5.0mol O2
C.保持温度和容器体积不变,再充入SO2和SO3,使之浓度扩大为原来的两倍
(3)利用电化学原理,将NO2、O2和熔融KNO3 制成燃料电池,其原理如图3所示.
该电池在工作过程中NO2转变成绿色硝化剂Y,Y是一种氧化物,可循环使用.石墨Ⅱ是电池的正极,石墨Ⅰ附近发生的电极反应式为NO2+NO3--e-=N2O5.相同条件下,消耗的O2和NO2的体积比为1:4.
(4)尾气中氮氧化物(NO和NO2)也可用尿素[CO(NH2)2]溶液除去,反应生成对大气无污染的气体.1mol 尿素能吸收工业尾气中氮氧化物(假设 NO、NO2体积比为 1:1)的质量为76g.
(1)汽车尾气中的 NO(g)和CO(g)在一定温度和催化剂的条件下可净化.发生的反应如下:2NO(g)+2CO(g)═2CO2 (g)+N2(g)
①已知:N2(g)+O2 (g)═2NO(g)△H=+180.0kJ/mol.部分化学键的键能如下(键能指气态原子形成1mol化学键释放的最小能量)
| 化学键 | O═O | C≡O | C═O |
| 键能(kJ/mol) | 497 | 1072 | 803 |
②若上述反应在绝热、恒容的密闭体系中进行,并在t1时刻达到平衡状态,则下列示意图1不符合题意的是C(填选项序号).(图中ω、M、v正 分别表示质量分数、混合气体平均相对分子质量、正反应速率)

(2)尾气中的SO2可先催化氧化生成SO3,再合成硫酸.已知:2SO2(g)+O2(g)═2SO3(g)△H=-196.0kJ/mol.
①在一定温度的密闭容器中,SO2的转化率随时间的变化关系如图2所示:
则A点的v逆(SO2 )小于(填大于、小于或等于)B点的 v正(SO2).
②在某温度时,向10L的密闭容器中加入4.0molSO2和10.0molO2,反应达到平衡,改变下列条件,再次达到平衡时,能使O2的新平衡浓度和原来平衡浓度相同的是BC(填选项序号).
A.在其他条件不变时,减小容器的容积
B.保持温度和容器内压强不变,再充入2.0mol SO2和5.0mol O2
C.保持温度和容器体积不变,再充入SO2和SO3,使之浓度扩大为原来的两倍
(3)利用电化学原理,将NO2、O2和熔融KNO3 制成燃料电池,其原理如图3所示.
该电池在工作过程中NO2转变成绿色硝化剂Y,Y是一种氧化物,可循环使用.石墨Ⅱ是电池的正极,石墨Ⅰ附近发生的电极反应式为NO2+NO3--e-=N2O5.相同条件下,消耗的O2和NO2的体积比为1:4.
(4)尾气中氮氧化物(NO和NO2)也可用尿素[CO(NH2)2]溶液除去,反应生成对大气无污染的气体.1mol 尿素能吸收工业尾气中氮氧化物(假设 NO、NO2体积比为 1:1)的质量为76g.