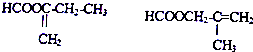题目内容
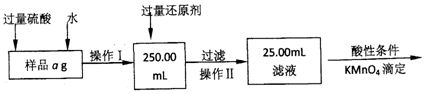
4.实验室有某氯化铁与氯化亚铁的混合物,现要测定其中铁元素的质量分数,实验按以下步骤进行:
Ⅰ.请根据上面流程,回答以下问题:
(1)操作1所用到玻璃仪器除烧杯、玻璃棒外,还必须有250mL容量瓶、胶头滴管.(填仪器名称)
(2)将沉淀物加热,冷却至室温,用天平称量其质量为b1g,再次加热灼烧并冷却至室温称量其质量b2g,若b1-b2=0.4g时,接下来还应进行的操作是,加热灼烧样品所需要的仪器有酒精灯、三脚架、玻璃棒、泥三角、坩埚、坩埚钳.
Ⅱ.有同学提出,还可以采用以下方法来测定:
(3)在量取待测液和滴定过程中需要用到的滴定管是B(填番号)
A 一支酸式滴定管和一支碱式滴定管 B 两支酸式滴定管 C 两支碱式滴定管
(4)若滴定用掉cmol/LKMnO4溶液bmL,则样品中铁元素的质量分数是$\frac{14bc}{5a}$(已知酸性条件下MnO4-被还原为Mn2+)
(5)在实验过程中,下列操作可能造成铁元素的质量分数偏低的是CD(填番号)
A.溶解样品时用稀盐酸代替稀硫酸
B.用铁单质做还原剂
C.量取滤液时未润洗对应滴定管
D.滴定前读数时滴定管内无气泡,滴定后有气泡残留在滴定管尖端
E.配制cmol/LKMnO4标准溶液时未将洗涤液一并转移入容量瓶
F.实验用滴定管准确量取25.00mL改为量取30.00mL于锥形瓶中来测定含有Fe2+的待测液.
分析 Ⅰ、采取的方法是加入盐酸和水使样品溶解,在容量瓶中配制250ml溶液,量取25.00ml溶液,加入溴水将亚铁离子氧化成铁离子、加入氨水使铁离子沉淀,过滤将所得氢氧化铁灼烧最终生成氧化铁,然后通过氧化铁质量来求铁的质量分数,
(1)操作I是配制溶液250.00ml,依据操作步骤分析所用到的玻璃仪器除烧杯、玻璃棒外,还有250ml容量瓶和胶头滴管;
(2)为了减少误差,需再次加热冷却并称量,直至两次质量差小于0.1g;固体灼烧需要在坩埚中进行加热,依据坩埚的使用方法和步骤选择仪器;
Ⅱ、样品ag加入过量硫酸和水配制250ml溶液,加入过量还原剂还原过滤取用25ml溶液在酸性条件下用高锰酸钾溶液滴定,发生反应5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O,(3)量取待测液和滴定过程中需要酸式滴定管滴定过程中装标准液高锰酸钾溶液,量取待测液亚铁离子和铁离子的溶液显酸性;需要两支酸式滴定管;
(4)依据高锰酸钾和亚铁离子的氧化还原反应定量关系计算;
(5)下列操作可能造成铁元素的质量分数偏高的选项分析为:
A.溶解样品时用稀盐酸代替稀硫酸,高锰酸钾溶液可以氧化氯离子,消耗标准液体积多;
B.用铁单质做还原剂,增加亚铁离子;
C.量取滤液时未润洗对应滴定管稀释标准液,滴定过程中消耗体积增大;
D.滴定前读数时满定管内无气泡,滴定后有气泡残留在滴定管尖端,读出的标准液体积减小;
E.配制c mol/L KMnO4标准溶液时未将洗涤液一并转移入容量瓶,配制的高锰酸钾溶液浓度偏小,滴定时消耗高锰酸钾溶液体积增大;
F.试验时在锥形瓶中放了25.5mL含有Fe2+的待测液,不影响测定溶液浓度.
解答 解:Ⅰ、(1)因配制一定物质的量浓度的溶液所需要的仪器有:量筒、胶头滴管、烧杯、玻璃棒、一定规格的容量瓶,
故答案为:250mL容量瓶;胶头滴管;
(2)为了减少误差,需再次加热冷却并称量,直至两次质量差小于0.1g;加热灼烧样品所需要的仪器有酒精灯、三脚架、玻璃棒、泥三角、坩埚、坩埚钳,
故答案为:再次加热冷却并称量,直至两次质量差小于0.1g;泥三角、坩埚、坩埚钳;
Ⅱ、(3)量取待测液和滴定过程中需要酸式滴定管滴定过程中装标准液高锰酸钾溶液,量取待测液亚铁离子和铁离子的溶液显酸性;需要两支酸式滴定管,故选B,
故答案为:B;
(4)设铁元素质量分数为X%,依据反应5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O;
5Fe2+~5Fe3+~KMnO4
5×56 1
a×X%×$\frac{25.00}{250.00}$ c×b×10-3
铁元素的质量分数是X%=$\frac{14bc}{5a}$,
故答案为:$\frac{14bc}{5a}$;
(5)A.溶解样品时用稀盐酸代替稀硫酸,高锰酸钾具有强氧化性,加入盐酸,溶液中的氯离子会被氧化,多消耗高锰酸钾,产生实验测定误差,结果偏高;
B.用铁单质做还原剂,含有铁离子生成亚铁离子增大,消耗标准液增大,结果偏高;
C.量取滤液时未润洗对应滴定管,待测液浓度减小,测定结果偏小;
D.滴定前读数时满定管内无气泡,滴定后有气泡残留在滴定管尖端,读出的标准液体积减小,结果偏小;
E.配制c mol/L KMnO4标准溶液时未将洗涤液一并转移入容量瓶,配制的高锰酸钾溶液浓度偏小,滴定时消耗高锰酸钾溶液体积增大,结果偏高;
F.试验时在锥形瓶中放了25.5mL含有Fe2+的待测液.浓度不变,无影响;
故选CD,
故答案为:CD.
点评 本题考查了溶液配制的方法和步骤,仪器选择,固体灼烧的仪器选择和步骤,滴定实验的过程分析判断,误差分析应用,题目难度中等.

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案| A. | 700C时,向纯水中加人H3PO4后,水的Kw减小 | |
| B. | 700C的Na2CO3溶液中c(Na+)>c(CO32-)c(HCO3-)>c(OH-)>c(H+) | |
| C. | 700C的H2S04溶液中c(H+)=c(OH-)+2c(SO42-) | |
| D. | 将室温下0.1 mol/L的NaOH溶液加热至700C时,c(OH-)/c(H+)随之增大 |
| A. | 前者大 | B. | 后者大 | C. | 两者一样 | D. | 无法确定 |
| A. | 乙烯在空气中燃烧时有黑烟,因此可以用燃烧法区别甲烷和乙烯 | |
| B. | 苯与浓硝酸在浓硫酸存在条件下加热发生取代反应 | |
| C. | 蛋白质溶液中加入饱和硫酸铵溶液,蛋白质发生变性 | |
| D. | 氨基酸能够以不同数目和顺序相结合形成结构复杂的多肽 |
(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原成三价铁离子达到净水的目的.按要求回答下列问题:
高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3X+5H2O,则X的化学式NaCl,反应中Fe被氧化.
(2)氧化铁红颜料跟某些油料混合,可以制成防锈油漆.以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如图:
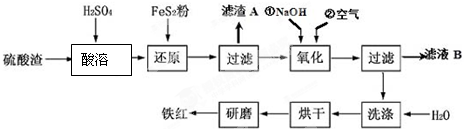
①酸溶过程中Fe2O3与稀硫酸反应的化学方程式为Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
“滤渣A”主要成份的化学式为SiO2.
②还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式:FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+.
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓.
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 |
| 开始沉淀Ph | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
 将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(l)
将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(l)(1)该反应的化学平衡常数表达式K=$\frac{c(C{H}_{3}OC{H}_{3})}{{c}^{2}(C{O}_{2}){c}^{6}({H}_{2})}$;
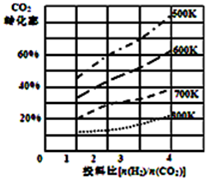
(2)已知在某压强下,该反应在不同温度、不同投料比时,达平衡时CO2的转化率如图所示:
①该反应的△H<0;(填“>”或“<”).
②若温度不变,减小反应投料比$\frac{n({H}_{2})}{n(C{O}_{2})}$,K值将不变(填“增大”、“减小”或“不变”);
③700K投料比$\frac{n({H}_{2})}{n(C{O}_{2})}$=2时,达平衡时H2的转化率a=45%;
(3)某温度下,向体积一定的密闭容器中通入CO2(g)与H2(g)发生上述反应,下列物理量不再发生变化时,能说明反应达到平衡状态的是ABC;
A.二氧化碳的浓度 B.容器中的压强
C.气体的密度 D.CH3OCH3与H2O的物质的量之比
(4)某温度下,在体积可变的密闭容器中,改变起始时加入各物质的量,在不同的压强下,平衡时CH3OCH3(g)的物质的量如表所示:
| P1 | P2 | P3 | |
| I.2.0molCO2 6.0molH2 | 0.10mol | 0.04mol | 0.02mol |
| Ⅱ.1.0mol CO2 3.0molH2 | X1 | Y1 | Z1 |
| Ⅲ.1.0molCH3OCH3 3.0molH2O | X2 | Y3 | Z2 |
②X1=0.05mol
③P2下Ⅲ中CH3OCH3的平衡转化率为96%.
| A. | H2SO4溶液与NaOH溶液混合 | B. | HCl气体通入Ca(OH)2溶液中 | ||
| C. | HNO3溶液与KOH溶液混合 | D. | NH4HSO4溶液与NaOH溶液混合 |
| A. | 在强碱溶液中:Na+、K+、CO32-、NO3- | |
| B. | 在pOH=2的溶液中:NH4+、Na+、SO42-、AlO2- | |
| C. | 在pH=1的溶液中:K+、Ag+、Mg2+、Fe2+ | |
| D. | 水电离出来的c(H+)=1×10-13 mol•L-1的溶液:K+、HCO3-、Br-、Ba2+ |

 .
.

 扑热息痛的结构简式为
扑热息痛的结构简式为