题目内容
【题目】工业上以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下图所示:
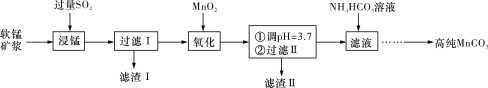
(1)“过滤Ⅰ”所得“滤渣Ⅰ”的主要成分为_________(填化学式)。
(2)“氧化”过程中除了发生MnO2与SO2的反应外,还发生另一氧化还原反应,写出该反应的离子方程式______________________________________________________________。
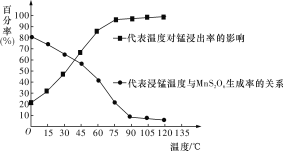
(3)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是____________________________________。
(4)向“过滤Ⅱ”所得的滤液中加入NH4HCO3溶液时温度控制在30~35 ℃,温度不宜太高的原因是_________________________________________________________________。
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有CO2气体生成,写出反应的离子方程式:_____________________________________________________________________。
(6)生成的MnCO3沉淀需经充分洗涤,检验沉淀是否洗涤干净的方法是___________________________________________________________________________。
【答案】SiO2 2Fe2++MnO2+4H+===2Fe3++Mn2++2H2O 90℃ 防止NH4HCO3受热分解,提高原料的利用率 Mn2++2HCO3-===MnCO3↓+CO2↑+H2O 取1~2mL最后一次的洗涤液于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净
【解析】
软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3):由流程可以知道软锰矿形成矿浆,通入足量的SO2,发生反应,MnO2+SO2=MnSO4,Fe2O3+SO2+2H+=2Fe2++SO42-+H2O,SiO2不反应,过滤,滤渣I为,滤液含有Mn2+、Fe2+,加入二氧化锰氧化亚铁离子,反应为:2Fe2++MnO2+4H+===2Fe3++Mn2++2H2O,调节pH,沉淀铁离子,过滤,滤渣II为氢氧化铁,向滤液中加入碳酸氢铵溶液,生成MnCO3沉淀,过滤得到的滤渣中主要含有MnCO3,反应为:Mn2++2HCO3-===MnCO3↓+CO2↑+H2O,通过洗涤、烘干得到MnCO3晶体,据此分析解答。
(1)软锰矿形成矿浆,通入足量的SO2,MnO2、Fe2O3与O2反应生成Mn2+、Fe2+,SiO2不反应,过滤,滤渣I为SiO2,
因此,本题正确答案是:SiO2;
(2) 加入二氧化锰氧化亚铁离子,反应为:2Fe2++MnO2+4H+===2Fe3++Mn2++2H2O,
因此,本题正确答案是:2Fe2++MnO2+4H+===2Fe3++Mn2++2H2O;
(3)由图可以知道,90℃时,MnS2O6的生成率低,锰浸出率高,温度再高,变化不大,则“浸锰”的适宜温度是90℃,
因此,本题正确答案是:90℃;
(4) NH4HCO3受热易分解,温度不宜太高,防止NH4HCO3受热分解,提高原料利用率,
因此,本题正确答案是:防止NH4HCO3受热分解,提高原料利用率;
(5) Mn2+的滤液中加入NH4HCO3溶液后,发生彻底的双水解,生成MnCO3沉淀和二氧化碳,反应为:Mn2++2HCO3-===MnCO3↓+CO2↑+H2O;
因此,本题正确答案是:Mn2++2HCO3-===MnCO3↓+CO2↑+H2O;
(6)生成的MnCO3沉淀需经充分洗涤,若未洗涤干净,洗涤液中含有硫酸根离子,故检验洗涤液中是否含有硫酸根即可,方法为:取1~2mL最后一次的洗涤液于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净,
因此,本题正确答案是: :取1~2mL最后一次的洗涤液于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净。

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案【题目】某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.
(1)该反应的离子方程式为 __________________________________ .
实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01molL-1、0.001molL-1,每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液(0.1molL-1)的用量均为2mL.在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得以下实验数据(从混合振荡均匀开始计时):
KMnO4酸性溶液的浓度/molL-1 | 溶液褪色所需时间t/min | ||
第1次 | 第2次 | 第3次 | |
0.01 | 14 | 13 | 11 |
0.001 | 6 | 7 | 7 |
(2)计算用0.001molL-1KMnO4酸性溶液进行实验时KMnO4的平均反应速率___________________________ (忽略混合前后溶液的体积变化).
(3)若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行? _____________________ .(填“行”或“不行”)