题目内容
【题目】某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.
(1)该反应的离子方程式为 __________________________________ .
实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01molL-1、0.001molL-1,每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液(0.1molL-1)的用量均为2mL.在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得以下实验数据(从混合振荡均匀开始计时):
KMnO4酸性溶液的浓度/molL-1 | 溶液褪色所需时间t/min | ||
第1次 | 第2次 | 第3次 | |
0.01 | 14 | 13 | 11 |
0.001 | 6 | 7 | 7 |
(2)计算用0.001molL-1KMnO4酸性溶液进行实验时KMnO4的平均反应速率___________________________ (忽略混合前后溶液的体积变化).
(3)若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行? _____________________ .(填“行”或“不行”)
【答案】2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O0.0001mol/(L·min)不行
【解析】
(1)高锰酸钾具有强氧化性,能将草酸氧化为二氧化碳,本身被还原为锰离子,离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
(2)反应开始时:c(KMnO4)=![]() =0.00067molL-1,反应时间:△t=
=0.00067molL-1,反应时间:△t=![]() =6.7min,KMnO4的平均反应速率v(KMnO4)=
=6.7min,KMnO4的平均反应速率v(KMnO4)=![]() =
=![]() =1×10-4mol/(Lmin),故答案为:1×10-4mol/(Lmin);
=1×10-4mol/(Lmin),故答案为:1×10-4mol/(Lmin);
(3)由题中数据知浓度大的褪色时间反而长,因颜色是由KMnO4产生,虽然KMnO4浓度大反应快,但KMnO4的量也多,故无法比较,故不经过计算直接利用表中的褪色时间长短来判断浓度大小与反应速率的关系是不可行的,故答案为:不行。

 阅读快车系列答案
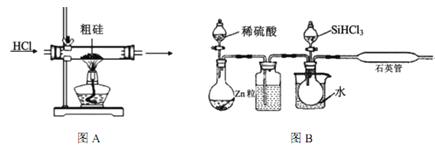
阅读快车系列答案【题目】半导体工业需要高纯硅,粗硅中含有SiO2、Fe2O3、CuO、C等杂质,提纯硅的方法比较多,其中三氯氢硅(有一定毒性)氢还原法和四氯化硅氢还原法应用较为广泛,下面是实验室模拟工业上三氯氢硅氢还原法的基本原理:
已知:①Si+3HCl ![]() SiHCl3+H2(主要反应)
SiHCl3+H2(主要反应)
Si+4HCl![]() SiCl4+2H2(次要反应)
SiCl4+2H2(次要反应)
2NaCl+H2SO4(浓)![]() Na2SO4+2HCl↑
Na2SO4+2HCl↑
②典型硅的重要化合物的部分性质如下表:
熔点(℃) | 沸点(℃) | 溶解性 | |
SiHCl3 | -127 | 33 | 易溶于多数有机溶剂 |
SiCl4 | -23 | 77 | 易溶于多数有机溶剂 |
(1)粗硅在提纯前,需要进行酸、碱预处理,其目的是___________________________________。
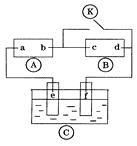
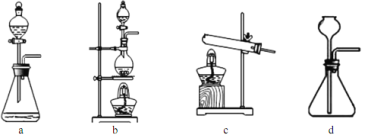
(2)下列装置在实验室可用于制备HCl气体的是_____(填字母代号)。
(3)在1100~1200℃条件下,利用图B在石英管中可以获得硅,写出该反应的方程式_______;其烧杯中水的作用是__________________________;该装置使用石英管而不是普通玻璃管的原因是_________。
(4)三氯氢硅氢还原法用 SiHCl3在图B中制硅,不足之处有_______________(任意回答一点即可)。
(5)SiCl4与氢气反应也能得到硅,但反应所需温度不同,在工业上往往将三氯氢硅中混入的SiCl4分离后再与氢气反应,你认为最好的分离方法是______________。
(6)工业上如果用四氯化硅氢还原法制硅,其原理如下:![]() 该方法与用三氯氢硅氢还原法比较,其缺点至少有两处,分别是_________________。
该方法与用三氯氢硅氢还原法比较,其缺点至少有两处,分别是_________________。