题目内容
A、B、C、D四种元素原子的核外电子数都比氩原子少,A和C同主族,两者间隔一个周期,B和D同主族,位于相邻两个周期.C、D可形成四核10电子的带一个单位正电荷的阳离子,则A离子的结构示意图为 ,B元素在周期表中的位置 .B与C形成常见化合物的结构式 ,A、C、D可形成常见化合物甲,用电子式表示化合物甲的形成过程 .A、B、C按1:1:1形成化合物乙的化学式 ,乙属于 化合物(填“离子”或“共价”);写出甲与乙反应的离子方程式 .A与D按1:1形成化合物的电子式是 ,该化合物中存在的化学键为 .
考点:位置结构性质的相互关系应用,化学键
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:A、B、C、D四种元素原子的核外电子数都比氩原子少,A和C同主族,两者间隔一个周期,则A、C为第一和第三周期元素,则为钠元素和氢元素,C、D可形成四核10电子的带一个单位正电荷的阳离子,则C为氢元素,A为钠元素,D为氧元素,B和D同主族,位于相邻两个周期,则B为硫元素,据此答题.
解答:
解:A、B、C、D四种元素原子的核外电子数都比氩原子少,A和C同主族,两者间隔一个周期,则A、C为第一和第三周期元素,则为钠元素和氢元素,C、D可形成四核10电子的带一个单位正电荷的阳离子,则C为氢元素,A为钠元素,D为氧元素,B和D同主族,位于相邻两个周期,则B为硫元素,所以A离子的结构示意图为 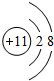 ,B元素在周期表中第3周期第ⅥA族,B与C形成常见化合物的结构式为H-S-H,A、C、D可形成常见化合物甲为氢氧化钠,用电子式表示化合物氢氧化钠的形成过程为
,B元素在周期表中第3周期第ⅥA族,B与C形成常见化合物的结构式为H-S-H,A、C、D可形成常见化合物甲为氢氧化钠,用电子式表示化合物氢氧化钠的形成过程为 ,A、B、C按1:1:1形成化合物乙的化学式为NaHS,乙属于离子化合物,甲与乙反应的离子方程式为HS-+OH-=H2O+S2-,A与D按1:1形成化合物为过氧化钠,它的电子式是
,A、B、C按1:1:1形成化合物乙的化学式为NaHS,乙属于离子化合物,甲与乙反应的离子方程式为HS-+OH-=H2O+S2-,A与D按1:1形成化合物为过氧化钠,它的电子式是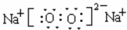 ,过氧化钠中存在的化学键为离子键和共价键,
,过氧化钠中存在的化学键为离子键和共价键,
故答案为: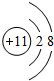 ;第3周期第ⅥA族;H-S-H;
;第3周期第ⅥA族;H-S-H;  ; NaHS;离子;HS-+OH-=H2O+S2-;
; NaHS;离子;HS-+OH-=H2O+S2-;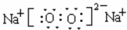 ;离子键和共价键;
;离子键和共价键;
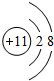 ,B元素在周期表中第3周期第ⅥA族,B与C形成常见化合物的结构式为H-S-H,A、C、D可形成常见化合物甲为氢氧化钠,用电子式表示化合物氢氧化钠的形成过程为
,B元素在周期表中第3周期第ⅥA族,B与C形成常见化合物的结构式为H-S-H,A、C、D可形成常见化合物甲为氢氧化钠,用电子式表示化合物氢氧化钠的形成过程为 ,A、B、C按1:1:1形成化合物乙的化学式为NaHS,乙属于离子化合物,甲与乙反应的离子方程式为HS-+OH-=H2O+S2-,A与D按1:1形成化合物为过氧化钠,它的电子式是
,A、B、C按1:1:1形成化合物乙的化学式为NaHS,乙属于离子化合物,甲与乙反应的离子方程式为HS-+OH-=H2O+S2-,A与D按1:1形成化合物为过氧化钠,它的电子式是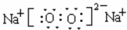 ,过氧化钠中存在的化学键为离子键和共价键,
,过氧化钠中存在的化学键为离子键和共价键,故答案为:
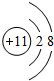 ;第3周期第ⅥA族;H-S-H;
;第3周期第ⅥA族;H-S-H;  ; NaHS;离子;HS-+OH-=H2O+S2-;
; NaHS;离子;HS-+OH-=H2O+S2-;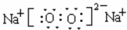 ;离子键和共价键;
;离子键和共价键;
点评:本题主要考查了结构示意图、电子式、化学键、离子反应等,难度不大,元素推断是解题的关键,答题时注意正确使用化学用语.

练习册系列答案
相关题目
下图分别表示四种操作,其中有两处错误的是( )
A、 读数 |
B、 稀释 |
C、 称量 |
D、 溶解 |
NA表示阿伏加德罗常数,下列判断正确的是( )
| A、含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol/L |
| B、标准状况下,22.4 L空气含有NA个单质分子 |
| C、1 L 0.1 mol/L氨水含有0.1NA个OH- |
| D、在18 g 18O2中含有NA个氧原子 |
下列离子方程式正确的是( )
| A、向40 mL 8 mol/L的硝酸溶液中加入5.6 g铁粉Fe+4H++N03-═Fe3++NO↑+2H2O |
| B、少量SO2通入Ca(ClO)2溶液中SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO |
| C、漂白粉溶液在空气中失效ClO-+CO2+H2O═HClO+HCO3- |
| D、Ba(OH)2溶液中滴加NaHSO4溶液至中性Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
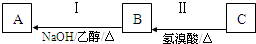 有机物A为链烃类化合物,质谱图表明其相对分子质量为70,其相关反应如图所示,其中A、B的结构中均含有2个-CH3,它们的核磁共振氢谱中均出现4个峰.请回答:
有机物A为链烃类化合物,质谱图表明其相对分子质量为70,其相关反应如图所示,其中A、B的结构中均含有2个-CH3,它们的核磁共振氢谱中均出现4个峰.请回答: