题目内容
1.(1)将浓硫酸滴在白纸上变黑,证明浓硫酸具有脱水性.(2)浓硫酸可以用铁槽车装运,证明浓硫酸具有强氧化性.
(3)加热铜片与浓硫酸的反应方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,证明浓硫酸具有酸性与强氧化性.
分析 (1)浓硫酸具有脱水性,能够使白纸脱水生成碳;
(2)根据浓硫酸能使铁的表面钝化分析;
(3)铜与浓硫酸在加热条件下发生氧化还原反应生成硫酸铜、二氧化硫和水,反应的方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,说明浓硫酸的酸性与强氧化性.
解答 解:(1)浓硫酸滴在白纸上,过一会儿,白纸变黑,体现浓硫酸脱水性;
故答案为:脱水性;
(2)浓硫酸强氧化性,能使铁的表面钝化,因此不能跟铁进一步反应,所以浓硫酸可以用铁槽车运输,故答案为:强氧化;
(3)铜与浓硫酸在加热条件下发生氧化还原反应生成硫酸铜、二氧化硫和水,反应的方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,说明浓硫酸的酸性与强氧化性,故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;酸性与强氧化性.
点评 本题考查浓硫酸的性质,熟悉浓硫酸有吸水性、脱水性、强氧化性是解答的关键,明确钝化发生氧化还原反应,题目难度不大.

练习册系列答案
相关题目
9.下列反应的生成物与反应物的量或反应条件无关的是( )
| A. | AlCl3与NH3•H2O | B. | NaOH与CO2 | C. | Na2CO3与HCl | D. | Na与O2 |
16.下列关于鉴别物质或除杂的方法能达到目的是( )
| A. | 用互滴的方法鉴别NaOH溶液和AlCl3溶液 | |
| B. | 除去MgCl2中少量AlCl3可用氨水 | |
| C. | 用KSCN溶液鉴别FeCl3溶液和Fe2(SO4)3溶液 | |
| D. | 用丁达尔效应鉴别NaCl溶液和KCl溶液 |
1.下列溶液中c(Cl-)与50mL 1mol•L-1AlCl3溶液中c(Cl-)相等的是( )
| A. | 75 mL 1.5 mol•L-1的MgCl2溶液 | B. | 75 mL 4 mol•L-1的NH4Cl溶液 | ||
| C. | 150 mL 2 mol•L-1的KCl溶液 | D. | 150 mL 1 mol•L-1的NaCl溶液 |
6.某温度下,相同pH的硫酸和硫酸铝溶液中由水电离出的c(H+)分别是l.0×l0-10mol/L和1.0×10-3 mol/L,则此温度下水的离子积Kw为( )
| A. | 1.0×l0-15 | B. | 1.0×10-14 | C. | 1.0×10-13 | D. | l.0×l0-7 |
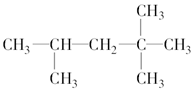 2,2,4-三甲基戊烷
2,2,4-三甲基戊烷 3,4-二甲基己烷
3,4-二甲基己烷