题目内容
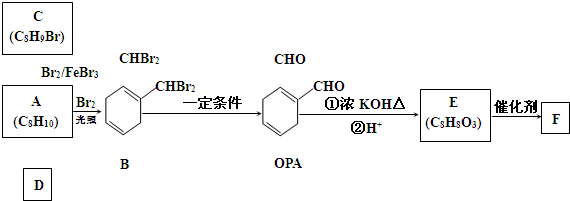
银、铜均属于重金属,从银铜合金废料中回收银并制备含铜化合物产品的工艺如图所示:
(1)熔炼时被氧化的元素是 ,酸浸时反应的离子方程式为 .为提高酸浸时铜元素的浸出率及浸出速率,酸浸前应对渣料进行处理,其处理方法是 .
(2)操作a是 ,固体B转化为CuAlO2的过程中,存在如下反应,请填写空白处: CuO+ Al2O3
+ ↑.
(3)若残渣A中含有n mol Ag,将该残渣全部与足量的稀HNO3置于某容器中进行反应,写出反应的化学方程式 .为彻底消除污染,可将反应中产生的气体与V L(标准状况)空气混合通入水中,则V至少为 L(设空气中氧气的体积分数为0.2).
(4)已知2Cu+
Cu+Cu2+,试分析CuAlO2分别与足量盐酸、稀硝酸混合后,产生现象的异同点 .
(5)假设粗银中的杂质只有少量的铜,利用电化学方法对其进行精炼,则粗银应与电源的 极相连,当两个电极上质量变化值相差30.4g时,则两个电极上银质量的变化值相差 g.

(1)熔炼时被氧化的元素是
(2)操作a是
| ||
(3)若残渣A中含有n mol Ag,将该残渣全部与足量的稀HNO3置于某容器中进行反应,写出反应的化学方程式
(4)已知2Cu+
| H+ |
(5)假设粗银中的杂质只有少量的铜,利用电化学方法对其进行精炼,则粗银应与电源的
考点:物质分离和提纯的方法和基本操作综合应用,铜金属及其重要化合物的主要性质
专题:
分析:由工艺流程图可知,废料在空气中熔炼时,Cu被氧化,滤渣中含有CuO及少量Ag,向滤渣中加入硫酸进行酸浸,CuO与硫酸反应,过滤得到硫酸铜溶液(含有硫酸),滤渣A为Ag;向滤液中加入硫酸铝、氢氧化钠,得到氢氧化铝、氢氧化铜,灼烧中会得到CuO、Al2O3,二者反应得到CuAlO2.
(1)由上述分析可知,空气中熔炼时Cu被氧化;用硫酸进行酸浸,CuO与硫酸反应生成硫酸铜与水;增大接触面积,加快反应速率;
(2)由上述分析可知,CuO、Al2O3反应得到CuAlO2,由电荷守恒可知,O元素化合价升高,有氧气生成,配平完成方程式;
(3)Ag与稀硝酸反应生成硝酸银、NO与水;反应生成的NO、氧气与水反应又得到硝酸,纵观整个过程,Ag失去电子等于氧气获得电子,据此计算氧气物质的量,再计算需要氧气的体积,结合空气中氧气体积分数计算需要空气体积;
(4)CuAlO2分别与足量盐酸反应得到Cu、氯化铜、氯化铝;硝酸具有强氧化性,过量的硝酸与CuAlO2反应得到硝酸铜、硝酸铝、NO;
(5)电解精炼时,粗银作阳极、纯银作阴极,阳极上Ag、Cu都失电子生成金属阳离子,阴极上只有银离子得电子生成Ag,两个电极上质量变化值相差30.4g为Cu放电析出的Ag的质量与Cu质量之差,根据电子转移守恒计算Cu放电时析出Ag的质量,即为两个电极上银质量的变化值之差.
(1)由上述分析可知,空气中熔炼时Cu被氧化;用硫酸进行酸浸,CuO与硫酸反应生成硫酸铜与水;增大接触面积,加快反应速率;
(2)由上述分析可知,CuO、Al2O3反应得到CuAlO2,由电荷守恒可知,O元素化合价升高,有氧气生成,配平完成方程式;
(3)Ag与稀硝酸反应生成硝酸银、NO与水;反应生成的NO、氧气与水反应又得到硝酸,纵观整个过程,Ag失去电子等于氧气获得电子,据此计算氧气物质的量,再计算需要氧气的体积,结合空气中氧气体积分数计算需要空气体积;
(4)CuAlO2分别与足量盐酸反应得到Cu、氯化铜、氯化铝;硝酸具有强氧化性,过量的硝酸与CuAlO2反应得到硝酸铜、硝酸铝、NO;
(5)电解精炼时,粗银作阳极、纯银作阴极,阳极上Ag、Cu都失电子生成金属阳离子,阴极上只有银离子得电子生成Ag,两个电极上质量变化值相差30.4g为Cu放电析出的Ag的质量与Cu质量之差,根据电子转移守恒计算Cu放电时析出Ag的质量,即为两个电极上银质量的变化值之差.
解答:
解:由工艺流程图可知,废料在空气中熔炼时,Cu被氧化,滤渣中含有CuO及少量Ag,向滤渣中加入硫酸进行酸浸,CuO与硫酸反应,过滤得到硫酸铜溶液(含有硫酸),滤渣A为Ag;向滤液中加入硫酸铝、氢氧化钠,得到氢氧化铝、氢氧化铜,灼烧中会得到CuO、Al2O3,二者反应得到CuAlO2.
(1)由上述分析可知,空气中熔炼时Cu被氧化;用硫酸进行酸浸,CuO与硫酸反应生成硫酸铜与水,反应离子方程式为:CuO+2H+=Cu2++H2O;将渣料粉碎,增大接触面积,加快反应速率;
故答案为:Cu;CuO+2H+=Cu2++H2O;将渣料粉碎;
(2)操作a是分离互不相溶的液体与固体,应是过滤;由上述分析可知,CuO、Al2O3反应得到CuAlO2,由电荷守恒可知,O元素化合价升高,有氧气生成,反应前Cu为+2价,反应后为+1,化合价降低1,反应前氧为-2价,反应后为0,化合价升高2,两者的最小公倍数是2,再根据原子守恒得:4CuO+2Al2O3=4CuAlO2+O2↑,
故答案为:过滤;4; 2; 4CuAlO2;O2;
(3)Ag与稀硝酸反应生成硝酸银、NO与水,反应方程式为:3Ag+4HNO3=3AgNO3+NO↑+2H2O;反应生成的NO、氧气与水反应又得到硝酸,纵观整个过程,Ag失去电子等于氧气获得电子,故消耗氧气物质的量为
=0.25n mol,标况下需要氧气的体积为0.25n mol×22.4L/mol=5.6n L,需要空气的体积为5.6n L÷20%=28n L,
故答案为:3Ag+4HNO3=3AgNO3+NO↑+2H2O;28n;
(4)CuAlO2分别与足量盐酸反应得到Cu、氯化铜、氯化铝,现象为得到蓝色溶液、有红色固体生成;硝酸具有强氧化性,过量的硝酸与CuAlO2反应得到硝酸铜、硝酸铝、NO,溶液变蓝色,相同点是均得到蓝色溶液;不同点是与盐酸混合有红色固体出现,而与硝酸混合没有固体出现,但有气泡产生,
故答案为:相同点是均得到蓝色溶液;不同点是与盐酸混合有红色固体出现,而与硝酸混合没有固体出现,但有气泡产生;
(5)电解精炼时,粗银作阳极、纯银作阴极,阳极上Ag、Cu都失电子生成金属阳离子,阴极上只有银离子得电子生成Ag,两个电极上质量变化值相差30.4g为Cu放电析出的Ag与Cu的质量之差,设Cu为xmol,根据电子转移守恒,则Cu放电形成Ag为2x mol,故2x×108-64x=30.4,解得x=0.2,两个电极上银质量的变化值之差为Cu放电生成Ag的质量,故为0.2mol×2×108g/mol=43.2g,
故答案为:正;43.2g.
(1)由上述分析可知,空气中熔炼时Cu被氧化;用硫酸进行酸浸,CuO与硫酸反应生成硫酸铜与水,反应离子方程式为:CuO+2H+=Cu2++H2O;将渣料粉碎,增大接触面积,加快反应速率;
故答案为:Cu;CuO+2H+=Cu2++H2O;将渣料粉碎;
(2)操作a是分离互不相溶的液体与固体,应是过滤;由上述分析可知,CuO、Al2O3反应得到CuAlO2,由电荷守恒可知,O元素化合价升高,有氧气生成,反应前Cu为+2价,反应后为+1,化合价降低1,反应前氧为-2价,反应后为0,化合价升高2,两者的最小公倍数是2,再根据原子守恒得:4CuO+2Al2O3=4CuAlO2+O2↑,
故答案为:过滤;4; 2; 4CuAlO2;O2;
(3)Ag与稀硝酸反应生成硝酸银、NO与水,反应方程式为:3Ag+4HNO3=3AgNO3+NO↑+2H2O;反应生成的NO、氧气与水反应又得到硝酸,纵观整个过程,Ag失去电子等于氧气获得电子,故消耗氧气物质的量为
| nmol×1 |
| 4 |
故答案为:3Ag+4HNO3=3AgNO3+NO↑+2H2O;28n;
(4)CuAlO2分别与足量盐酸反应得到Cu、氯化铜、氯化铝,现象为得到蓝色溶液、有红色固体生成;硝酸具有强氧化性,过量的硝酸与CuAlO2反应得到硝酸铜、硝酸铝、NO,溶液变蓝色,相同点是均得到蓝色溶液;不同点是与盐酸混合有红色固体出现,而与硝酸混合没有固体出现,但有气泡产生,
故答案为:相同点是均得到蓝色溶液;不同点是与盐酸混合有红色固体出现,而与硝酸混合没有固体出现,但有气泡产生;
(5)电解精炼时,粗银作阳极、纯银作阴极,阳极上Ag、Cu都失电子生成金属阳离子,阴极上只有银离子得电子生成Ag,两个电极上质量变化值相差30.4g为Cu放电析出的Ag与Cu的质量之差,设Cu为xmol,根据电子转移守恒,则Cu放电形成Ag为2x mol,故2x×108-64x=30.4,解得x=0.2,两个电极上银质量的变化值之差为Cu放电生成Ag的质量,故为0.2mol×2×108g/mol=43.2g,
故答案为:正;43.2g.
点评:本题以从废料中回收银并制备铜化工产品载体,考查化学工艺流程、物质分离提纯、电解原理、氧化还原反应配平与计算,(3)(5)中计算抓住电子转移守恒进行解答,难度中等.

练习册系列答案
相关题目
将a g二氧化锰粉末加入b mol?L-1的浓盐酸c L中加热完全溶解,反应中转移电子d个,设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A、可以收集到氯气
| ||
| B、反应后溶液中的Cl-数目为2aNA/87 | ||
C、NA可表示为
| ||
| D、反应后溶液中的H+数目为(bc-2d) |
下列有关能量转化的说法中正确的是( )
| A、铝热反应属于吸热反应 | ||||
| B、“H-CI→H+C1“过程中放出热量 | ||||
| C、干冰升华过程放出热量 | ||||
D、 反应“C+H2O
|
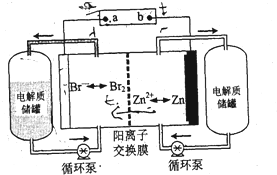 锌溴液流电池是一种新型电化学储能装置(如图所示)电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环,下列说法正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示)电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环,下列说法正确的是( )| A、充电时电极b连接电源的正极 |
| B、放电时正极的电极反应式为Zn-2e-=Zn2+ |
| C、阳离子交换膜可阻止Br2与Zn直接发生反应 |
| D、充电时左侧电解质储罐中的离子总浓度增大 |
如图X、Y、A、B、C均为短周期主族元素,其中只有一种是金属元素,则下列说法错误是( )
| X | A | ||
| Y | C | B |
| A、原子半径大小:Y>C>X>A |
| B、Y和B形成的化合物中Y和B的原子个数比为2:3 |
| C、X、C、A中最高价氧化物对应的水化物的酸性最强的是A |
| D、A、B均为非金属元素,所以两者的氢化物相遇不发生反应 |