题目内容
13. 最近意大利罗马大学的科学家获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1molN-N吸收167kJ热量,生成1molN≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )
最近意大利罗马大学的科学家获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1molN-N吸收167kJ热量,生成1molN≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )| A. | N4属于一种新型的化合物 | |
| B. | N4与N2互称为同位素 | |
| C. | N4化学性质比N2稳定 | |
| D. | 1molN4沸气体转变为N2将放出882kJ热量 |
分析 A、化合物是由不同种元素组成的纯净物;
B、质子数相同,中子数不同的两种核素之间互为同位素;
C、物质内部能量越低越稳定;
D、根据化学反应中旧键断裂吸收的能量和新键生成释放的能量差即为化学反应中的能量变化来回答.
解答 解:A、化合物是由不同种元素组成的纯净物,N4属于一种新型的单质,故A错误;
B、质子数相同,中子数不同的两种核素之间互为同位素,N4与N2互称为同素异形体,故B错误;
C、根据D的分析,1molN4转变为N2为放热反应,反应物的总能量高于生成物,物质能量越低越稳定,故化学性质N2比N4稳定,故C错误;
D、1molN4气体中含有6molN-N键,可生成2molN2,形成2molN≡N键,则1molN4气体转变为N2化学键断裂断裂吸收的热量为6×167kJ=1002kJ,形成化学键放出的热量为1884kJ,所以反应放热,放出的热量为1884kJ-1002kJ=882kJ,故放出882kJ热量,故D正确;
故选D.
点评 本题考查较为综合,考查纯净物、同位素以及同素异形体的概念等知识,注意知识的梳理和归纳是解答的关键,难度不大.

练习册系列答案
相关题目
4.下列比较关系与排列顺序错误的是( )
| A. | 酸性 H2SiO3<H3PO4<H2SO4 | B. | 碱性 Ca(OH)2>Mg(OH)2>Al(OH)3 | ||
| C. | 稳定性SiH4>NH3>H2O>HF | D. | 原子半径大小:Na>S>O |
1.下列反应中,与其它三个反应不属于同一类型的反应是( )
| A. |  +HNO3$→_{△}^{浓硫酸}$ +HNO3$→_{△}^{浓硫酸}$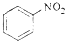 +H2O +H2O | |
| B. | CH2═CH2+Br2→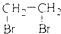 | |
| C. | CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O | |
| D. | CH4+Cl2 $\stackrel{光}{→}$ CH3Cl+HCl |
8.PH3一种无色剧毒气体,其分子结构和NH3相似,但P-H键键能比N-H键键能低.下列判断错误的是( )
| A. | PH3分子中存在极性共价键 | |
| B. | P-H键键长比N-H键键长长 | |
| C. | PH3沸点低于NH3沸点,因为P-H键键能低 | |
| D. | PH3分子稳定性低于NH3分子,因为N-H键键能高 |
18.在能使紫色石蕊变红的溶液中,下列各组离子可大量共存的是( )
| A. | Ag+、K+、Ba2+、I- | B. | AlO2-、S2-、PO43-、Na+ | ||
| C. | Fe2+、Cu2+、Mg2+、NO3- | D. | NH4+、Fe3+、Br-、SO42- |
5.下列电子式书写正确的是( )
| A. |  | B. |  | C. |  | D. |  |
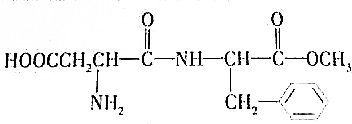

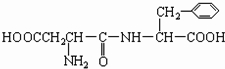 和CH3OH(填结构简式)
和CH3OH(填结构简式) 、
、 和甲醇.
和甲醇. (填结构简式,该分子中除苯环以外,还含有一个6原子组成的环)
(填结构简式,该分子中除苯环以外,还含有一个6原子组成的环)