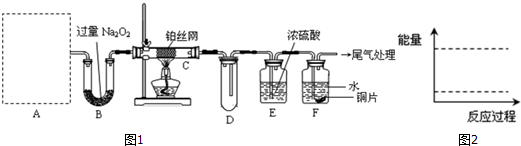
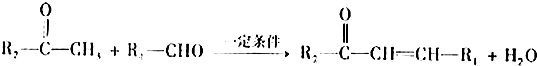题目内容
一定条件下,Na2CO3溶液存在水解平衡CO32-+H2O?HCO3-+OH-,升高温度,
怎样变化.
| C(HCO3-) |
| C(CO32-) |
考点:盐类水解的应用
专题:盐类的水解专题
分析:盐的水解是吸热反应,升高温度促进水解,据此分析.
解答:
解:盐的水解是吸热反应,升高温度促进水解,Na2CO3溶液存在水解平衡CO32-+H2O?HCO3-+OH-,升高温度,水解平衡正移,则
变大,
答:
变大.
| C(HCO3-) |
| C(CO32-) |
答:
| C(HCO3-) |
| C(CO32-) |
点评:本题考查了盐的水解原理,侧重于影响水解平衡的因素的考查,题目难度不大.

练习册系列答案
相关题目
气态废弃物中的硫化氢可用电化学的方法转化为可利用的硫:配制一份电解质溶液,主要成分为:K4[Fe(CN)6](200g/L)和KHCO3(60g/L);通电电解,通入H2S气体.过程中涉及硫化氢转化为硫的总反应:2Fe(CN)63-+2CO32-+H2S=2Fe(CN)64-+2HCO3-+S,则下列说法不正确的是( )
| A、电解过程中的阳极反应为:[Fe(CN)6]2--e-=[Fe(CN)6]3- |
| B、电解过程中阴极附近溶液的pH降低 |
| C、电解过程中每处理l mol硫化氢气体,理论上转移电子2 mol |
| D、该处理方法理论上不需要补充电解质溶液 |
观察下列模型并结合有关信息进行判断,下列说法错误的是( )
| HCN | S8 | SF6分子 | B12结构单元 | |
| 结构模型示意图 |  |  |  |  |
| 备注 | / | 易溶于CS2 | / | 熔点1873K |
| A、HCN的结构式为H-C≡N |
| B、固态硫S8属于原子晶体 |
| C、SF6是由极性键构成的非极性分子 |
| D、单质硼属原子晶体,结构单元中含有30个B-B键 |
如图为周期表中短周期的一部分,若X原子最外层电子数比次外层电子数少3,则下列说法正确的是( )
| R | ||
| X | Y | Z |
| A、X的氢化物比Z的氢化物稳定 |
| B、原子半径大小顺序是Z>Y>X |
| C、Y、R形成的化合物YR3能使酸性KMnO4溶液褪色 |
| D、X、Z可形成化合物XZ3,分子中各原子均满足最外层8电子的稳定结构 |