题目内容
1.下列离子方程式正确的是( )| A. | 向AlCl3溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 将Al投入到烧碱溶液中:2Al+2OH-═AlO2-+2H2O | |
| C. | 将Al(OH)3投入到烧碱溶液中:Al(OH)3+OH-═AlO2-+2H2O | |
| D. | 向NaHCO3溶液中加入适量KOH溶液:HCO3-+OH-═CO2↑+H2O |
分析 A.不符合反应客观事实;
B.原子个数不守恒;
C.二者反应生成偏铝酸钠和水;
D.反应实质是碳酸氢根离子与氢氧根离子生成碳酸根离子和水;
解答 解:A.氢氧化铝不溶于氨水,二者反应的离子方程式为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故A错误;
B.NaOH溶液和铝片的反应与氢氧化钠量的多少没有关系,往过量和少量NaOH溶液中投入铝片均发生反应:2Al+2OH-+2H2O═2AlO2-+3H2↑,故B错误;
C.将Al(OH)3投入到烧碱溶液中,离子方程式:Al(OH)3+OH-═AlO2-+2H2O,故C正确;
D.向NaHCO3溶液中加入适量KOH溶液,离子方程式:HCO3-+OH-═CO32-+H2O,故D错误;
故选:C.
点评 本题目考查学生离子方程式的书写和正误的判断方法,明确离子方程式书写方法是解题关键,难度不大.

练习册系列答案
相关题目
11.绿矾(FeSO4•7H2O)广泛用于工农业生产.下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生成纯净绿矾的一种方法:
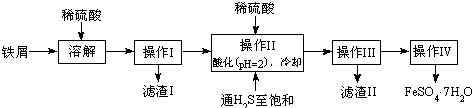
查询资料,得有关物质的数据如下表:
(1)操作II中,通入硫化氢至饱和的目的是除去Sn2+并防止Fe2+被氧化;在溶液中用硫酸酸化至pH=2的目的是防止Fe2+沉淀;
(2)操作IV得到的绿矾晶体用少量冰水洗涤,其洗涤的目的是洗去晶体表面的硫酸等杂质;用冰水的原因是降低晶体的溶解度,减少溶解导致FeSO4•7H2O的损耗;
(3)次氯酸盐在碱性条件下氧化硫酸亚铁可得高冷净水剂K2FeO4,离子方程式为2ClO-+Fe2++4OH-=FeO42-+2Cl-+2H2O;
(4)25℃时,将FeSO4•7H2O样品溶于水配成FeSO4溶液,该溶液中的Fe2+在空气中易被氧化成Fe3+,若向完全被氧化后的溶液中滴加NaOH溶液,当滴至溶液的pH=4时,溶液中的c(Fe3+)=4.0×10-8mol/L.[已知该温度下,Fe(OH)3的Ksp=4.0×10-38]
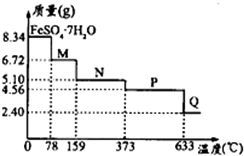
(5)将8.34gFeSO4•7H2O样品隔绝空气加热脱水,其热重曲线(样品质量随温度变化的曲线)如图所示:
①在100℃时M的化学式为FeSO4•4H2O;
②FeSO4•7H2O晶体中有3种不同结合力的水分子.

查询资料,得有关物质的数据如下表:
| 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
(2)操作IV得到的绿矾晶体用少量冰水洗涤,其洗涤的目的是洗去晶体表面的硫酸等杂质;用冰水的原因是降低晶体的溶解度,减少溶解导致FeSO4•7H2O的损耗;
(3)次氯酸盐在碱性条件下氧化硫酸亚铁可得高冷净水剂K2FeO4,离子方程式为2ClO-+Fe2++4OH-=FeO42-+2Cl-+2H2O;
(4)25℃时,将FeSO4•7H2O样品溶于水配成FeSO4溶液,该溶液中的Fe2+在空气中易被氧化成Fe3+,若向完全被氧化后的溶液中滴加NaOH溶液,当滴至溶液的pH=4时,溶液中的c(Fe3+)=4.0×10-8mol/L.[已知该温度下,Fe(OH)3的Ksp=4.0×10-38]
(5)将8.34gFeSO4•7H2O样品隔绝空气加热脱水,其热重曲线(样品质量随温度变化的曲线)如图所示:
①在100℃时M的化学式为FeSO4•4H2O;
②FeSO4•7H2O晶体中有3种不同结合力的水分子.

16.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH下列叙述正确的是( )
| A. | 放电时每转移3mol电子,正极有1molK2FeO4被氧化 | |
| B. | 放电时负极反应为Zn+2e-+2OH-═Zn(OH)2 | |
| C. | 充电时阳极反应为Fe(OH)3-3e-+5OH-═FeO42-+4H2O | |
| D. | 放电时正极附近溶液的碱性减弱 |
6.发生在美国的墨西哥湾原油泄漏事件极大地破坏了生态环境,该事件警示人类应合理的开发和利用能源.随着经济的飞速发展,机动车越来越多,对石油产品的需求激增,为了环保和降低成本,很多国家转型研究电动车.LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车.电池的正极材料是LiFePO4,负极材料是石墨,含U导电固体为电解质,电池反应为:FePO4+Li$?_{充电}^{放点}$LiFePO4.下列有关LiFePO4电池说法正确的是( )
| A. | 可加入烧碱溶液以提高电池的性能,碱性电池的能量和可储存时间均较高 | |
| B. | 放电时电池内部Li+向负极移动 | |
| C. | 充电过程中,电池正极材料的质量减少 | |
| D. | 放电时电池正极反应为:FePO4+Li+-e-═LiFePO4 |
10.如果25℃时,Kw=1.0×10-14,100℃下Kw=1.0×10-12.下列说法错误的是( )
| A. | 100℃下水的电离程度较大 | B. | 前者的C(H+)较后者小 | ||
| C. | 水的电离过程是一个放热过程 | D. | 温度越高,Kw越大 |
11.在某表面被氧化的钢铁样品a g中,加入稀硫酸150 mL,放出标准状况下的H2 b L,且样品完全溶解.向反应后的溶液里滴加KSCN溶液无明显现象.为使样品中的铁元素完全沉淀下来,恰好消耗3mol•L-1的NaOH溶液200mL,则原稀硫酸的物质的量浓度是( )
| A. | 2 mol•L-1 | B. | 3.36 mol•L-1 | ||
| C. | 1.5 mol•L-1 | D. | 缺少数据,无法计算 |
 碳酸钠-过氧化氢加合物(aNa2CO3•bH2O2)具有漂白、杀菌作用.实验室用“醇析法”制备该物质的实验步骤如下:
碳酸钠-过氧化氢加合物(aNa2CO3•bH2O2)具有漂白、杀菌作用.实验室用“醇析法”制备该物质的实验步骤如下: 清洁能源具有广阔的开发和应用前景,可减少污染解决雾霾问题,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池.
清洁能源具有广阔的开发和应用前景,可减少污染解决雾霾问题,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池.