题目内容
有以下物质 ①Fe、②AgCl固体、③熔融Ba (OH)2、④Al2(SO4)3溶液、
⑤SO2、⑥蔗糖溶液、⑦食盐水、⑧H2CO3、⑨无水乙醇(C2H5OH).其中属于非电解质的有(填数字序号,下同) ;属于电解质的有 ,请写出Ba(OH)2在水溶液中的电离方程式 .
⑤SO2、⑥蔗糖溶液、⑦食盐水、⑧H2CO3、⑨无水乙醇(C2H5OH).其中属于非电解质的有(填数字序号,下同)
考点:电解质与非电解质,电离方程式的书写
专题:
分析:根据电解质的定义分析,在水溶液里或熔融状态下能导电的化合物是电解质,包括酸、碱、盐、金属氧化物和水;
在水溶液里或熔融状态下都不能导电的化合物是非电解质,包括非金属氧化物、一些氢化物和大部分有机物;根据电离方程式的书写规则来解答.
在水溶液里或熔融状态下都不能导电的化合物是非电解质,包括非金属氧化物、一些氢化物和大部分有机物;根据电离方程式的书写规则来解答.
解答:
解:在水溶液里和熔融状态下都不能导电的化合物是非电解质⑤SO2 ⑨无水乙醇属于非电解质;
在水溶液里或熔融状态下能导电的化合物是电解质,所以②AgCl固体、③熔融Ba (OH)2、⑧H2CO3是电解质;
氢氧化钡溶于水完全电离,电离方程式为:Ba(OH)2=Ba2++2OH-;
故答案为:⑤⑨;②③⑧;Ba(OH)2=Ba2++2OH-.
在水溶液里或熔融状态下能导电的化合物是电解质,所以②AgCl固体、③熔融Ba (OH)2、⑧H2CO3是电解质;
氢氧化钡溶于水完全电离,电离方程式为:Ba(OH)2=Ba2++2OH-;
故答案为:⑤⑨;②③⑧;Ba(OH)2=Ba2++2OH-.
点评:本题考查了电解质、非电解质的定义电离方程式的书写,较简单,注意单质和混合物既不是电解质也不是非电解质.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
量取10mL碘的饱和水溶液,倒入分液漏斗中,然后注入4mL四氯化碳,用力振荡后静置,实验现象为( )
| A、液体分层,上层为四氯化碳层,黄色 |
| B、液体分层,上层为水层,紫色 |
| C、液体分层,下层为四氯化碳层,紫色 |
| D、液体分层,下层为水层,黄色 |
下列有关实验操作和说法正确的是( )
| A、用pH试纸检验气体的酸碱性时,一定要先用蒸馏水润湿 |
| B、润洗滴定管:从滴定管上口加入所要盛装的酸或碱溶液至“0”刻线,再将液体从滴定管下部放出,重复操作2~3次 |
| C、用瓷坩埚加热熔化碳酸钠固体 |
| D、Mg和Al分别为电极,插入NaOH溶液中,构成原电池,探究Mg、Al的活泼性 |
下列物质的分类正确的是( )
| 混合物 | 非电解质 | 强电解质 | 碱 | |
| A | 漂白粉 | Cl2 | NaCl溶液 | 氨水 |
| B | 盐酸 | NH3 | CH3COOH | Cu2(OH)2CO3 |
| C | 胆矾 | SO2 | Ba(OH)2 | 纯碱 |
| D | Fe(OH)3胶体 | C2H5OH | CaCO3 | 苛性钠 |
| A、A | B、B | C、C | D、D |
某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):根据以上规律判断,下列结论正确的是( )
A、 若反应为2A(g)+B(g)?2C(g),则△H>0,P2>P1 |
B、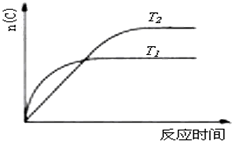 若反应为2A(g)?C(g),则△H>0,T1>T2 |
C、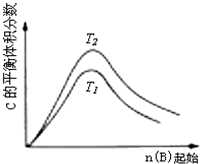 反应为3A(g)+B(g)?2C(g),则△H>0,T2>T1;或△H<0,T2<T1 |
D、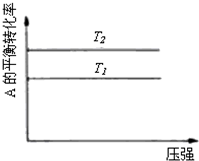 反应为A(g)+B(g)?2C(g),则△H<0,T2>T1 |
某探究小组利用丙酮的溴代反应(CH3COCH3+Br2→CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系.反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定.在一定温度下,获得如下实验数据:分析实验数据所得出的结论不正确的是( )
| 实验 序号 | 初始浓度c/mol?L-1 | 溴颜色消失 所需时间t/s | ||
| CH3COCH3 | HCl | Br2 | ||
| ① | 0.80 | 0.20 | 0.001 0 | 290 |
| ② | 1.60 | 0.20 | 0.001 0 | 145 |
| ③ | 0.80 | 0.40 | 0.001 0 | 145 |
| ④ | 0.80 | 0.20 | 0.002 0 | 580 |
| A、增大c(CH3COCH3),v(Br2)增大 |
| B、实验②和③的v(Br2)相等 |
| C、增大c(HCl),v(Br2)增大 |
| D、增大c(Br2),v(Br2)增大 |
将0.2mol MnO2和50mL 12mol?L-1盐酸混合后缓缓加热,反应完全后,再向溶液中加入足量AgNO3溶液,生成AgCl沉淀的物质的量为(不考虑盐酸的挥发)( )
| A、等于0.3 mol |
| B、小于0.3 mol |
| C、大于0.3 mol,小于0.6 mol |
| D、以上结论都不正确 |