题目内容
12.氢氟酸是一种弱酸,已知25℃时:在20mL 0.1mol•L-1氢氟酸中加入V mL pH=13NaOH溶液.请填空:
(1)氢氟酸的电离方程式为HF?H++F-.
(2)写出氢氟酸的电离平衡常数表达式:K=$\frac{[{H}^{+}][{F}^{-}]}{[HF]}$.
(3)当V=20时,所得溶液显碱性(填“酸”、“中”、“碱”).
分析 (1)氢氟酸是一种弱酸,溶液中存在电离平衡,离子方程式用可逆号;
(2)电离平衡常数等于溶液中电离出的离子浓度的幂次方乘积除以平衡状态下分子的浓度;
(3)等物质的量的氢氟酸和氢氧化钠恰好反应生成氟化钠,溶液呈碱性;
解答 解:(1)氢氟酸是一种弱酸,溶液中存在电离平衡,电离方程式为:HF?H++F-,故答案为:HF?H++F-;
(2)电离方程式为:HF?H++F-,氢氟酸的电离平衡常数表达式:K=$\frac{[{H}^{+}][{F}^{-}]}{[HF]}$,故答案为:$\frac{[{H}^{+}][{F}^{-}]}{[HF]}$;
(3)在20mL 0.1mol•L-1氢氟酸中加入V mL pH=13NaOH溶液,当V=20时,氢氟酸和氢氧化钠等物质的量恰好完全反应,HF+NaOH=NaF+H2O,等物质的量反应生成NaF,氟化钠是强碱弱酸盐,溶液显碱性,
故答案为:碱;
点评 本题考查了弱电解质电离平衡,电离方程式,电离平衡常数的理解应用,熟练掌握基础知识是解题关键,题目较简单.

练习册系列答案
相关题目
3.下列电解质在水中的电离方程式书写正确的是( )
| A. | KHSO4═K++H++SO42- | B. | NaHCO3═Na++H++CO32- | ||
| C. | Mg(NO3)2═Mg2++(NO3)22- | D. | KClO3═K++Cl5-+3O2- |
20.有一种滋补品,其有效成分的结构简式如图,下列对该化合物的叙述不正确的是( )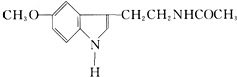

| A. | 它属于芳香族化合物 | B. | 它属于高分子化合物 | ||
| C. | 分子式为C13N2H16O2 | D. | 在一定条件下可以发生加成反应 |
7.25℃时某水溶液中c(H+)等于10-10mol/L,该溶液的溶质不可能是( )
| A. | Ba(OH)2 | B. | HCl | C. | NH3•H2O | D. | CH3COONa |
17.关于制备Fe(OH)3胶体的操作方法正确的是( )
| A. | 在FeCl3溶液中加入NaOH溶液 | B. | 加热煮沸FeCl3溶液 | ||
| C. | 把FeCl3溶液滴入沸水中 | D. | 把饱和的FeCl3溶液滴入到沸水中 |
4.两种电解装置:①以铜为电极电解Na2SO4溶液;②以铂为电极电解Na2SO4溶液.当两装置中产生的氢气质量相同时,两装置消耗的水的质量之比为( )
| A. | 1:1 | B. | 1:2 | ||
| C. | 2:1 | D. | 有一装置不消耗水,无法比较 |
1.只用一种试剂可区别Na2SO4、MgCl2、FeCl2、Al2(SO4)3、(NH4)2SO4五种溶液,这种试剂是( )
| A. | NaOH | B. | H2SO4 | C. | BaCl2 | D. | AgNO3 |
2. 隔膜电解法是一种处理高浓度乙醛废水的新方法,乙醛分别在阴、阳极发生反应转化为乙醇和乙酸.实验室以一定浓度的乙醛-硫酸钠溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法正确的是( )
隔膜电解法是一种处理高浓度乙醛废水的新方法,乙醛分别在阴、阳极发生反应转化为乙醇和乙酸.实验室以一定浓度的乙醛-硫酸钠溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法正确的是( )
 隔膜电解法是一种处理高浓度乙醛废水的新方法,乙醛分别在阴、阳极发生反应转化为乙醇和乙酸.实验室以一定浓度的乙醛-硫酸钠溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法正确的是( )
隔膜电解法是一种处理高浓度乙醛废水的新方法,乙醛分别在阴、阳极发生反应转化为乙醇和乙酸.实验室以一定浓度的乙醛-硫酸钠溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法正确的是( )| A. | 若以氢氧燃料电池为直流电源,燃料电池的b极应通入空气 | |
| B. | 电解过程中,两极除分别生成乙酸和乙醇外,均产生了无色气体,则阳极产生的是O2 | |
| C. | 阳极反应CH3CHO-2e-+2H+═CH3COOH+H2O | |
| D. | 电解过程中,由于硫酸钠不参与电极反应,故阳极区始终c(Na+)=2 c(SO42-) |