题目内容
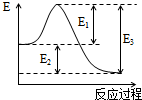 (1)如图为表示某反应过程的能量变化曲线.
(1)如图为表示某反应过程的能量变化曲线.①该图能否表示反应N2+O2=2NO(△H>0)的反应过程?
②图中表示该反应反应热的是
(2)已知25℃、101kPa时,无水乙醇燃烧的热化学方程式为:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1366.8kJ/mol无水乙醇的燃烧热为
考点:反应热和焓变,有关反应热的计算,燃烧热
专题:化学反应中的能量变化
分析:(1)①从图上分析,反应物能量高于生成物,反应放热;
②反应热等于生成物与反应物的能量差;活化能是指反应发生时所需要的最小能量;
(2)燃烧热是指1mol可燃物完全燃烧释放的热量,生成液态水和二氧化碳气体;23g乙醇是0.5mol,据热化学方程式可得答案.
②反应热等于生成物与反应物的能量差;活化能是指反应发生时所需要的最小能量;
(2)燃烧热是指1mol可燃物完全燃烧释放的热量,生成液态水和二氧化碳气体;23g乙醇是0.5mol,据热化学方程式可得答案.
解答:
解:(1)①图示反应是放热反应,不能表示吸热反应,故答案为:否 图中曲线表示的是放热反应,而该反应为吸热反应;
②反应热等于生成物与反应物的能量差,图示中的E2;反应的活化能是指烦也烦死时所需要的能量,图上的E1,故答案为:E2;E1;
(2)燃烧热是指1mol可燃物完全燃烧释放的热量,所以,乙醇的燃烧热为1366.8 kJ/mol,23g乙醇的物质的量为
=0.5mol,燃烧放热为683KJ,故答案为:1366.8 kJ/mol;683.4.
②反应热等于生成物与反应物的能量差,图示中的E2;反应的活化能是指烦也烦死时所需要的能量,图上的E1,故答案为:E2;E1;
(2)燃烧热是指1mol可燃物完全燃烧释放的热量,所以,乙醇的燃烧热为1366.8 kJ/mol,23g乙醇的物质的量为
| 23g |
| 46g?mol-1 |
点评:本题考查学生的识图能力,并通过图示考查燃烧活化能、反应热,还考查了对燃烧热概念的理解.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
同温下,甲、乙两瓶醋酸的浓度分别为1mol/L和0.1mol/L,则甲、乙两瓶醋酸中c(H+)之比是( )
| A、大于10 | B、小于10 |
| C、等于10 | D、无法确定 |
下列说法正确的是( )
| A、在多电子的原子里,能量高的电子通常在离核近的区域内活动 |
| B、任何元素的原子都是由核外电子和核内中子、质子组成的 |
| C、40 18Ar、40 19K、40 20Ca的质量数相同,所以它们是互为同位素 |
| D、核素指一种原子,而元素是指一类原子;核素间互称同位素,元素包含同位素 |
 在某一容积为5L的密闭容器内,加入0.3mol的CO和0.3mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:
在某一容积为5L的密闭容器内,加入0.3mol的CO和0.3mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应: