题目内容
11.硅在地壳中的含量较高.硅及其化合物的开发由来已久,在现代生活中有广泛应用.回答下列问题:(1)1810年瑞典化学家贝采利乌斯在加热石英砂、木炭和铁时,得到一种“金属”,这种“金属”可能是含有硅碳的铁合金.
(2)陶瓷、水泥和玻璃是常用的硅酸盐材料.其中,生产普通玻璃的主要原料有纯碱、石英和石灰石.
(3)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料.工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
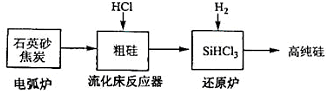
| 发生的主要反应 | |
| 电弧炉 | SiO2+2C$\stackrel{1600-1800℃}{?}$Si+2CO↑ |
| 流化床反器 | Si+3HCl$\stackrel{250-300℃}{?}$SiHCl3+H2 |
| 还原炉 | SiHCl3+H2$\stackrel{1100-1200℃}{?}$Si+3HCl |
②在流化床反应的产物中,SiHCl3大约占 85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和精馏(或蒸馏).
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
(4)氯碱工业可为上述工艺生产提供部分原料,这些原料是H2、HCl.
分析 (1)石英砂主要成分为二氧化硅,碳做还原剂还原二氧化硅为单质硅;
(2)生产玻璃的原料是纯碱、石英和石灰石;
(3)①石英砂主要成分为二氧化硅,二氧化硅和碳在高温的条件下反应生成碳化硅和一氧化碳;碳化硅又称金刚砂,其晶体结构与金刚石相似;
②根据题中数据,采用精馏(或蒸馏)方法提纯SiHCl3;
③SiHCl3水解生成硅酸、氢气和氯化氢;
(4)电解饱和食盐水称为氯碱工业,结合上述工艺流程解答.
解答 解:(1)石英砂的主要成分是二氧化硅,加热石英砂、木炭和铁时,发生置换反应,SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,所以在加热石英砂、木炭和铁时,得到一种“金属”.这种“金属”可能是含有硅碳的铁合金,
故答案为:含有硅碳的铁合金;
(2)制造普通玻璃的主要原料是:纯碱、石灰石和石英,在玻璃窑中强热时的主要发生反应:SiO2+Na2CO3 $\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑、SiO2+CaCO3 $\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑,
故答案为:纯碱、石英和石灰石;
(3)①石英砂的主要成分是二氧化硅,在反应中生成碳化硅,反应为:SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑,碳化硅又称金刚砂,其晶体结构与金刚石相似,
故答案为:SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑;金刚砂;金刚石;
②利用沸点的不同提纯SiHCl3属于蒸馏,SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),由于沸点差别较大,可以通过精馏(或蒸馏)除去杂质,
故答案为:精馏(或蒸馏);
③SiHCl3水解反应方程式为:SiHCl3+3H2O═H2SiO3+H2↑+3HCl↑,生成硅酸、氢气和氯化氢,
故答案为:H4SiO4(或H2SiO3)、H2、HCl;
(4)氯碱工业主要反应为电解饱和食盐水:2NaCl+2H2O $\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,为该化学工艺提供H2、HCl,
故答案为:H2、HCl.
点评 本题考查了实验方案设计的有关知识,侧重考查了硅及其化合物的有关知识,注意粗硅的提纯反应原理,对知识进行迁移解决情形相似的新问题体现出知识运用与问题分析的能力是本题的特点,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(1)依据题给条件.你认为他们能完成哪些因素对速率形响的探究?HNO3浓度、温度、大理石的表面积.
(2)请根据(I)中选择的探究内容.填写以下实验设计表.完成探究实验:
| 实验编号 | T/℃ | 大理石规格 | HNO3浓度/mol•L-1 |
| ① | 常温 | 2.00 | |
| ② | 1.00 | ||
| ③ | 2.00 | ||
| ④ | 2.00 |
 (3)整个实验中应控制的不变量是硝酸溶液体积和CaCO3质量.
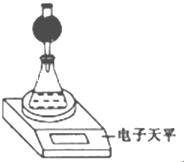
(3)整个实验中应控制的不变量是硝酸溶液体积和CaCO3质量.(4)该实验小组用如图实验装置进行实验.
①除电于天平、干燥管、锥形瓶、药匙、胶塞等仪器外.必需的实验仪器还有量筒、秒表.干燥管中放置的试剂可以是bc(填序号).
a.碱石灰 b.无水CaCl2 c.P2O5固体 d.浓硫酸
③若撤除干燥管装置,所测速率偏大(填“偏大”“偏小”或“不变”).
| W | 单质是淡黄色固体 |
| X | 在地壳中的含量居第二位 |
| Y | 原子最外层电子数是电子总数的$\frac{2}{3}$ |
| Z | 第三周期原子半径最小的金属元素 |
| A. | 气态氢化物的热稳定性:X>W | |
| B. | 最高价氧化物对应水化物的酸性:Y>X | |
| C. | 离子半径:Z>W | |
| D. | Z 的氧化物不具有两性 |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
| A. | 滴定终点时溶液由无色变为浅红色且保持半分钟颜色不变 | |
| B. | 滴定终点时混合溶液的pH=7 | |
| C. | 滴定终点时反应的热效应即为中和热 | |
| D. | 滴定终点时两者恰好完全反应 |
| A. | 标准状况下,3.36 L氟化氢中含有的电子数目为1.5NA | |
| B. | 常温常压下,7.0 g乙烯与丙烯的混合物中含有共用电子对的数目为1.5NA | |
| C. | 标准状况下,22.4 L己烷中含共价键数目为19 NA | |
| D. | 18 g D2O和18 g H2O中含有的质子数均为10NA |
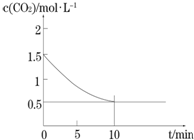 一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,CO2的浓度与时间的关系如图所示.
一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,CO2的浓度与时间的关系如图所示.