题目内容
5.双氧水在医疗、军事和工业生产等方面用途广泛,在医疗上可用于流感消毒,化学工业常用作生产过碳酸钠、过氧乙酸等大原料,工业上采用醇析法经H2O2转化为碳酸钠晶体(2Na2CO3•3H2O2),该晶体具有碳酸钠和过氧化物的双重性质,其工业生产工艺过程如下:
请回答下列问题;
(1)试剂厂先获得7%~8%的氧化氢溶液,再浓缩成30%的溶液,浓缩时可采用的适宜方法是减压蒸馏.
(2)对于CO中毒、冠心病等危重患者都要采用吸氧治疗.普通医务室中没有氧气瓶,但一般都有消毒用的30%的H2O2溶液.同时还有可选用的试剂为:KMnO4、H2SO4、K2SO4、Mg、CuSO4、NaCl和葡萄糖.请利用上述某些试剂写出一种使H2O2中的氧完全释放出来的理想反应的离子方程式5H2O2+2MnO4-+6H+=2Mn2++5O2↑+8H2O.
(3)将过氧化氢转化为过碳酸钠晶体的目的是为了贮存运输和使用的方便,加入异丙醇的作用是降低过碳酸钠的溶解度,有利于晶体的析出.
(4)生产工艺中将反应温度控制在0~5℃的理由是低温下H2O2与2Na2CO3•3H2O2稳定,2Na2CO3•3H2O2溶解度更小.
(5)工艺流程中的稳定剂能相互反应,生成一种不溶物将过碳酸钠包住,该反应的化学方程式为MgCl2+Na2SiO3=MgSiO3↓+2NaCl.
分析 过氧化氢为液体,难以贮存和运输,工业常见过氧化氢转化为过碳酸钠,生成时将反应温度控制在0~5℃,目的是防止在较低温度下2Na2CO3•3H2O2溶解度更小,且过氧化氢和过碳酸钠较稳定,加入稳定剂,发生MgCl2+Na2SiO3=MgSiO3↓+2NaCl,不溶物将过碳酸钠粒子包住,由于2Na2CO3•3H2O2具有Na2CO3和Na2O2的双重性质;
(1)过氧化氢受热易分解,浓缩过程中要采取措施降低温度,通常可用降低溶液沸点的方法;
(2)过氧化氢中的氧完全转化为氧气,是氧化过程,需要添加氧化剂,可选择的氧化剂为酸性条件下的高锰酸钾溶液,结合电子守恒、电荷守恒及原子守恒来配平相应的离子方程式;
(3)过氧化氢不稳定,而过碳酸钠晶体稳定且易保存和运输;过碳酸钠在异丙醇中的溶解度较小;
(4)在低温时H2O2与2Na2CO3•3H2O2稳定(不易分解)且2Na2CO3•3H2O2的溶解度小;
(5)根据元素守恒可书写化学方程式.
解答 解:(1)为防止过氧化氢的分解,通常采用减压蒸馏的方法来浓缩7%~8%的氧化氢溶液为30%的溶液,故答案为:减压蒸馏;
(2)利用酸性的高锰酸钾溶液氧化过氧化氢得到氧气,发生反应的离子方程式为:5H2O2+2MnO4-+6H+=2Mn2++5O2↑+8H2O;故答案为:5H2O2+2MnO4-+6H+=2Mn2++5O2↑+8H2O;
(3)过氧化氢为液体,且在在一定条件下可发生分解,难以贮存和运输,溶液加入异丙醇后可得到过碳酸钠晶体,说明过碳酸钠在异丙醇中的溶解度较小,易与分离,
故答案为:为了贮存运输和使用的方便;降低过碳酸钠的溶解度,有利于晶体的析出;
(4)生成时将反应温度控制在0~5℃,目的是防止在较低温度下2Na2CO3•3H2O2溶解度更小,且过氧化氢和过碳酸钠较稳定,
故答案为:低温下H2O2与2Na2CO3•3H2O2稳定,2Na2CO3•3H2O2溶解度更小;
(5)稳定剂发生MgCl2+Na2SiO3=MgSiO3↓+2NaCl,不溶物将过碳酸钠粒子包住,
故答案为:MgCl2+Na2SiO3=MgSiO3↓+2NaCl;
点评 本题考查物质制备的实验设计,侧重于钠的化合物的性质及氧化还原反应理论的考查,注意把握制备原理,结合题给信息解答,答题时注意审题,要具备较强的审题能力和自学能力.

| A. | 某反应的△H>0、△S<0,则该反应一定不能正向自发进行 | |
| B. | 用简易量热计测定反应热时,需用环形玻璃搅拌棒搅拌使酸和碱充分反应 | |
| C. | 化合反应一定是放热反应,分解反应不一定是吸热反应 | |
| D. | 为加快漂粉精的漂白速率,使用时可滴加几滴醋酸 |
| A. | 氮气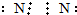 | B. | 氨基H:N:H | ||
| C. | 过氧化氢H+[:O:]2-H+ | D. | 氯化钠Na+[:Cl:]- |
 硼镁泥是一种工业废料,主要成份是MgO,还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的流程如下:
硼镁泥是一种工业废料,主要成份是MgO,还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的流程如下: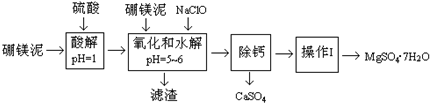
已知:NaClO与Mn2+反应产生MnO2沉淀.
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |
(1)请提出两条加快酸解速率的措施升温、把硼镁泥粉碎、搅拌等.
(2)NaClO能将溶液中的还原性离子氧化生成沉淀,写出有关反应的离子方程式Mn2++ClO-+H2O=MnO2↓+2H++Cl-、2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cll-+4H+.
(3)除去滤渣之前,往往还要加入一定量的硼镁泥,其原因可能是调节溶液pH,使Fe3+、Al3+水解完全,除去多余的NaClO.
(4)“除钙”MgSO4和CaSO4的混合溶液中的CaSO4除去,根据下表数据,应将混合溶液蒸发浓缩、趁热过滤;再将滤液进行“操作Ⅰ”,则析出晶体后的溶液(20℃)中c(Mg2+)=2.00mol•L-1(该溶液的密度为1.20g•cm-3).
已知MgSO4、CaSO4的溶解度如表:
| 温度(℃) | 20 | 40 | 50 | 60 | 70 |
| MgSO4 | 25.0 | 31.8 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.256 | 0.212 | 0.207 | 0.201 | 0.190 |
| A. | $\frac{1}{1}H$和$\frac{2}{1}H$互为同位素 | B. | 淀粉和纤维素互为同分异构体 | ||
| C. |  和 和 属于同一种物质 属于同一种物质 | D. | C2H6和C4H10互为同系物 |

 、
、 .
. 向一洁净干燥的烧杯中加入44.4gAl粉与Fe粉混合物,然后加入过量的盐酸,产生标况下气体26.88L.若将该混合物加入500ml15mol•L-的浓HNO3中(不考虑发生钝化),产生的气体(标准状况下测定)如图所示,假设HNO3的还原产物为NO与NO2,那么理论上从哪一时刻开始产生NO气体.( )
向一洁净干燥的烧杯中加入44.4gAl粉与Fe粉混合物,然后加入过量的盐酸,产生标况下气体26.88L.若将该混合物加入500ml15mol•L-的浓HNO3中(不考虑发生钝化),产生的气体(标准状况下测定)如图所示,假设HNO3的还原产物为NO与NO2,那么理论上从哪一时刻开始产生NO气体.( )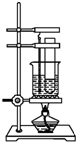 实验室用苯和浓硝酸、浓硫酸发生反应制取硝基苯的装置如图所示.回答下列问题:
实验室用苯和浓硝酸、浓硫酸发生反应制取硝基苯的装置如图所示.回答下列问题: .
.