题目内容
 合成氨工业的出现大大缓解了人类粮食危机,合成氨工业的核心反应是:N2+3H2
合成氨工业的出现大大缓解了人类粮食危机,合成氨工业的核心反应是:N2+3H2 | 催化剂 |
| 高温高压 |
(1)在反应体系中加入催化剂,反应速率增大,E1和E2的变化:E1
(2)在2×107Pa和催化剂条件下向一密闭容器中充入0.5mol N2和1.5mol H2,充分反应后,放出的热量
(3)最近化学家使用了一种新催化剂,在常温下合成氨.下列有关说法错误的是
A.旧法合成氨是吸热反应,新法合成氨是放热反应
B.新法合成氨不需要在高温条件下,可节约大量能源,具有发展前景
C.在常温下进行的新法合成氨也需要断裂化学键
D.新催化剂降低了反应所需要的能量,提高了活化分子百分数.
考点:反应热和焓变,工业合成氨
专题:化学反应中的能量变化
分析:(1)加入催化剂,降低反应的活化能,但反应热不变;
(2)根据可逆反应的特点分析;
(3)催化剂可降低反应的活化能,加快反应速率,新催化剂,在常温下合成氨,可节约能源.
(2)根据可逆反应的特点分析;
(3)催化剂可降低反应的活化能,加快反应速率,新催化剂,在常温下合成氨,可节约能源.
解答:
解:(1)加入催化剂,降低反应的活化能,则E1和E2都减小,但活化能之差不变,则反应热不变,故答案为:减小;减小;不变;
(2)当0.5mol N2和1.5mol H2完全反应时,才能放出46.2kJ的热量,但反应为可能反应,不能完全进行,则密闭容器中充入0.5mol N2和1.5mol H2,充分反应后,放出的热量小于46.2kJ,
故答案为:<;当0.5mol N2和1.5mol H2完全反应时,才能放出46.2kJ的热量,但此反应不能进行到底,所以放热小于46.2kJ;
(3)A.旧法合成氨与新法合成氨都是放热反应,故A错误;
B.与旧法相比较,新法合成氨不需要在高温条件下,可节约大量能源,具有发展前景,故B正确;
C.化学反应的实质是旧键的断裂和新键的形成,新法合成氨能在常温下进行是因为催化剂降低了反应所需的活化能,故C正确;
D.催化剂降低反应的活化能,可提高活化分子百分数,加快反应速率,故D正确.
故答案为:A.
(2)当0.5mol N2和1.5mol H2完全反应时,才能放出46.2kJ的热量,但反应为可能反应,不能完全进行,则密闭容器中充入0.5mol N2和1.5mol H2,充分反应后,放出的热量小于46.2kJ,
故答案为:<;当0.5mol N2和1.5mol H2完全反应时,才能放出46.2kJ的热量,但此反应不能进行到底,所以放热小于46.2kJ;
(3)A.旧法合成氨与新法合成氨都是放热反应,故A错误;
B.与旧法相比较,新法合成氨不需要在高温条件下,可节约大量能源,具有发展前景,故B正确;
C.化学反应的实质是旧键的断裂和新键的形成,新法合成氨能在常温下进行是因为催化剂降低了反应所需的活化能,故C正确;
D.催化剂降低反应的活化能,可提高活化分子百分数,加快反应速率,故D正确.
故答案为:A.
点评:本题考查较为综合,以合成氨为载体考查化学反应与能力,侧重于学生的分析能力的考查,注意把握相关基础知识,了解催化剂的性质,难度不大.

练习册系列答案
相关题目
下列各装置中铜电极上能产生气泡的是( )
A、 |
B、 |
C、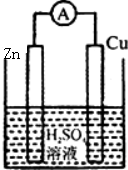 |
D、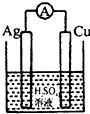 |
下列各图有关量的变化趋势中错误的是( )
A、 图为向盐酸中滴加NaOH发生中和反应过程中溶液温度的变化趋势 |
B、 图为向醋酸中滴加NaOH发生中和反应过程中各物质浓度的变化趋势 |
C、 图中能量≥Ec的分子称为活化分子,E为分子平均能量,则活化能为Ec-E |
D、 图为未加入催化剂和加入催化剂的反应进程中的能量变化 |
下列表示对应化学反应的离子方程式正确的是( )
| A、FeBr2溶液中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl- |
| B、FeCl3溶液与Cu反应:Cu+Fe3+=Cu2++Fe2+ |
| C、醋酸溶解水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ |
| D、向Na[Al(OH)4]溶液中通入过量CO2:2[Al(OH)4]-+CO2=2Al(OH)3↓+CO32-+H2O |
某学生欲完成反应Cu+H2SO4═CuSO4+H2↑而设计了下列四个实验,你认为可行的是( )
A、 H2SO4 |
B、 H2SO4 |
C、 H2SO4 |
D、 H2SO4 |

 利用所学化学反应原理,解决以下问题:
利用所学化学反应原理,解决以下问题: