题目内容
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、常温常压下,22.4L CH4中含有4NA个C-H键 |
| B、1mol Fe与足量稀硝酸反应,转移2NA个电子 |
| C、0.5mol?L-1 FeCl3溶液中含有1.5NA个Cl- |
| D、常温下,22g CO2含有NA个氧原子 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、依据气体摩尔体积的条件应用分析判断,标准状况气体摩尔体积为22.4L/mol;
B、1mol Fe与足量稀硝酸反应生成硝酸铁,一氧化氮和水;
C、溶液体积不知不能计算微粒数;
D、依据n=
计算物质的量结合分子式计算氧原子数;
B、1mol Fe与足量稀硝酸反应生成硝酸铁,一氧化氮和水;
C、溶液体积不知不能计算微粒数;
D、依据n=
| m |
| M |
解答:
解:A、标准状况气体摩尔体积为22.4L/mol,常温常压下,22.4L CH4物质的量不是1mol,故A错误;
B、1mol Fe与足量稀硝酸反应生成硝酸铁,一氧化氮和水,转移3NA个电子,故B错误;
C、0.5mol?L-1 FeCl3溶液中,溶液体积不知不能计算微粒数,故C错误;
D、依据n=
计算物质的量=
=0.5mol,结合分子式计算氧原子数=0.5mol×2×NA=NA,故D正确;
故选D.
B、1mol Fe与足量稀硝酸反应生成硝酸铁,一氧化氮和水,转移3NA个电子,故B错误;
C、0.5mol?L-1 FeCl3溶液中,溶液体积不知不能计算微粒数,故C错误;
D、依据n=
| m |
| M |
| 22g |
| 44g/mol |
故选D.
点评:本题考查了就到了的分析应用,主要是气体摩尔体积的应用条件分析,氧化还原反应产物的判断和电子转移计算,注意溶液中离子数计算需要溶液浓度和体积,题目较简单.

练习册系列答案
 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
下列有关说法不正确的是( )
| A、根据化合物在水溶液或熔融状态下是否导电,将化合物分为电解质和非电解质 |
| B、氨气的水溶液能够导电,因此NH3是电解质 |
| C、电解质溶液的导电能力与溶液中离子浓度及离子所带电荷多少有关 |
| D、溶液与胶体的本质区别是分散质颗粒直径大小 |
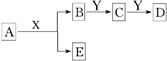 中学化学中,常见无机物A、B、C、D、E、X、Y存在如下图转化关系(部分生成物和反应条件略去).下列推断正确的是( )
中学化学中,常见无机物A、B、C、D、E、X、Y存在如下图转化关系(部分生成物和反应条件略去).下列推断正确的是( )| A、若A是CaC2,X是H2O,则Y一定是溴水 |
| B、若A是金属钠,X是H2O,则E一定能还原Fe2O3 |
| C、若Y是NaOH,C是白色沉淀,则A与X一定发生置换反应 |
| D、若Y是氧气,D是氧化物,则A与X一定发生氧化还原反应 |
在由水电离出的c(OH-)=1×10-13 mol?L-1的溶液中,能大量共存的离子组是( )
| A、Fe2+ Na+ NO3- Cl- |
| B、Ba2+ Na+ NO3- Cl- |
| C、SO42- SO32- NH4+ Na+ |
| D、Mg2+ Na+ Br- ClO- |
短周期元素W、X、Y、Z的原子序数依次增大,且原子最外层电子数之和为14.W的原子半径比X的大,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最高的金属元素,Z原子的最外层电子数是其电子层数的2倍.下列说法正确的是( )
| A、元素X的最高价氧化物对应的水化物的酸性比Z的弱 |
| B、元素Y、Z的简单离子的电子层结构相同 |
| C、元素W与Z形成的化合物为共价化合物 |
| D、原子半径由大到小的顺序为:r(Z)>r(Y)>r (W) |
下列说法中正确的是( )
| A、伴有能量变化的物质变化都是化学变化 |
| B、放热反应在常温下一定很容易发生 |
| C、吸热反应只有在点燃条件下才能发生 |
| D、反应是吸热还是放热是由反应物和生成物所具有的总能量的相对大小而决定的 |
 如图所示,组成一个原电池.
如图所示,组成一个原电池.