题目内容
 如图所示,组成一个原电池.
如图所示,组成一个原电池.(1)当电解质溶液为稀硫酸时:
①Fe电极是
②Cu电极是
(2)当电解质溶液为稀硝酸时:
①Fe电极是
②Cu电极是
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)①活泼性强的金属做负极,失电子发生氧化反应;
②活泼性弱的金属作正极,正极上阳离子得电子发生还原反应;
(2)①Fe做负极,失电子发生氧化反应;
②Cu作正极,正极上硝酸根离子得电子发生还原反应.
②活泼性弱的金属作正极,正极上阳离子得电子发生还原反应;
(2)①Fe做负极,失电子发生氧化反应;
②Cu作正极,正极上硝酸根离子得电子发生还原反应.
解答:
解:(1)①活泼性强的金属做负极,所以Fe作负极,Fe失电子发生氧化反应生成亚铁离子,其电极反应式为:Fe-2e-=Fe2+;
故答案为:负;Fe-2e-=Fe2+;氧化;
②活泼性弱的金属作正极,所以Cu为正极,正极上溶液中的氢离子得电子发生还原反应,生成氢气,其电极反应式为:2H++2e-=H2↑;
故答案为:正;2H++2e-=H2↑;还原;
(2)①Fe做负极,Fe失电子发生氧化反应,生成铁离子,其电极反应式为:Fe-3e-=Fe3+;
故答案为:负;Fe-3e-=Fe3+;氧化;
②Cu作正极,正极上硝酸根离子得电子发生还原反应,生成NO,其电极反应式为:4H++NO3-+3e-=NO↑+2H2O;
故答案为:正;4H++NO3-+3e-=NO↑+2H2O;还原.
故答案为:负;Fe-2e-=Fe2+;氧化;
②活泼性弱的金属作正极,所以Cu为正极,正极上溶液中的氢离子得电子发生还原反应,生成氢气,其电极反应式为:2H++2e-=H2↑;
故答案为:正;2H++2e-=H2↑;还原;
(2)①Fe做负极,Fe失电子发生氧化反应,生成铁离子,其电极反应式为:Fe-3e-=Fe3+;
故答案为:负;Fe-3e-=Fe3+;氧化;
②Cu作正极,正极上硝酸根离子得电子发生还原反应,生成NO,其电极反应式为:4H++NO3-+3e-=NO↑+2H2O;
故答案为:正;4H++NO3-+3e-=NO↑+2H2O;还原.
点评:本题考查了原电池原理,主要涉及了电极的判断、电极方程式的书写,侧重于基础知识的考查,题目难度不大.

练习册系列答案
相关题目
将足量CO2通入下列各溶液中,所含离子还能大量共存的是( )
| A、Na+、S2-、OH-、SO42- |
| B、Na+、C6H5O-、CH3COO-、HCO3- |
| C、H+、NH4+、Al3+、SO42- |
| D、K+、SiO32-、Cl-、NO3- |
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、常温常压下,22.4L CH4中含有4NA个C-H键 |
| B、1mol Fe与足量稀硝酸反应,转移2NA个电子 |
| C、0.5mol?L-1 FeCl3溶液中含有1.5NA个Cl- |
| D、常温下,22g CO2含有NA个氧原子 |
CH3-CH═CH2加聚形成的聚合物是( )
A、 |
B、 |
C、 |
D、 |
 ,它可以发生如下反应:
,它可以发生如下反应:


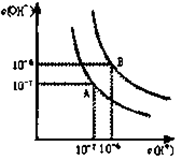 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示: