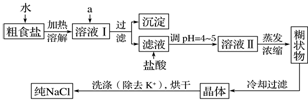
题目内容
2.在溶液的配制过程中会引起浓度偏高的是( )| A. | 用1g98%的浓硫酸加4g水配制成19.6%的硫酸 | |
| B. | 配制一定物质的量浓度的硫酸溶液时,定容后,塞好塞子倒转摇匀后,发现液面低于刻度线 | |
| C. | 10%的硫酸和90%的硫酸等体积混合配制50%的硫酸溶液 | |
| D. | 质量分数为5x%和x%的两种氨水等体积混合配制成3x%的氨水 |
分析 A.根据溶剂质量不变,溶液质量由1g变为5g,质量分数变为原先的$\frac{1}{5}$;
B.由于容量瓶刻度线上方有部分残留溶液,所以摇匀后液面会低于刻度线,属于正确现象;
C.硫酸的质量分数越大,溶质的密度越大,10%的硫酸和90%的硫酸等体积混合后溶质质量分数大于两溶液质量分数的平均值;
D.氨水密度小于1,5x%和x%的两种氨水等体积混合后溶液质量分数小于两溶液质量分数的平均值.
解答 解:A.用1g 98%的浓硫酸加4g水,所得溶液中硫酸的质量分数为:$\frac{1×98%}{1+5}$×100%=19.6%,该操作合理,浓度正确,故A不选;
B.配制一定物质的量浓度的硫酸溶液时,定容后,塞好塞子倒转摇匀后,由于容量瓶刻度线上方有残留的溶液,所以液面会低于刻度线,不会影响配制结果,故B不选;
C.硫酸的密度大于1,10%的硫酸和90%的硫酸等体积混合,所得溶液的质量分数大于50%,故C选;
D.氨水密度小于1,质量分数为5x%和x%的两种氨水等体积混合所得溶液质量分数小于3x%,故D不选;
故选:C.
点评 本题考查了配制一定浓度的溶液方法及误差分析的判断,题目难度中等,注意掌握配制一定浓度的溶液步骤,明确分析误差的方法与技巧,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
相关题目
13.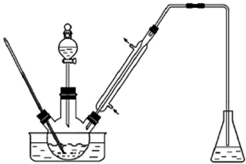 实验室以苯甲醛为原料制备间溴苯甲醛(实验装置主要部分如图,相关物质的沸点见附表),附表相关物质的沸点(101kPa)
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置主要部分如图,相关物质的沸点见附表),附表相关物质的沸点(101kPa)
步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后,升温至60℃,缓慢滴加经H2SO4干燥过的液溴,保温反应一段时间,冷却.
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液.
步骤3:有机相用10%NaHCO3溶液洗涤,再加入适量无水MgSO4固体,放置一段时间后过滤;
步骤4:减压蒸馏有机相,收集相应馏分.
(1)实验装置中可能的错误有锥形瓶内可能会发生倒吸、胶塞可能被有机物腐蚀,冷凝管进水口是a;
(2)有同学建议将装置中温度计换成搅拌棒,那么温度计应移到什么地方使用水浴中;
(3)步骤2后续操作是搅拌、静置、分液;
(4)步骤3中用10%NaHCO3溶液洗涤的具体操作是在分液漏斗中将有机相与小苏打溶液充分振荡再分液,重复二到三次,加入无水MgSO4固体的作用是除去有机相的水.
(5)步骤4中采用蒸馏分离,请你预测蒸馏温度应先选择约D℃,再选择约E℃.
A.50 B.100 C.150 D.200 E.250 F.300.
 实验室以苯甲醛为原料制备间溴苯甲醛(实验装置主要部分如图,相关物质的沸点见附表),附表相关物质的沸点(101kPa)
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置主要部分如图,相关物质的沸点见附表),附表相关物质的沸点(101kPa)| 物质 | 沸点/℃ | 物质 | 沸点/℃ |
| 溴 | 58.8 | 1,2-二氯乙烷 | 83.5 |
| 苯甲醛 | 179 | 间溴苯甲醛 | 229 |
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液.
步骤3:有机相用10%NaHCO3溶液洗涤,再加入适量无水MgSO4固体,放置一段时间后过滤;
步骤4:减压蒸馏有机相,收集相应馏分.
(1)实验装置中可能的错误有锥形瓶内可能会发生倒吸、胶塞可能被有机物腐蚀,冷凝管进水口是a;
(2)有同学建议将装置中温度计换成搅拌棒,那么温度计应移到什么地方使用水浴中;
(3)步骤2后续操作是搅拌、静置、分液;
(4)步骤3中用10%NaHCO3溶液洗涤的具体操作是在分液漏斗中将有机相与小苏打溶液充分振荡再分液,重复二到三次,加入无水MgSO4固体的作用是除去有机相的水.
(5)步骤4中采用蒸馏分离,请你预测蒸馏温度应先选择约D℃,再选择约E℃.
A.50 B.100 C.150 D.200 E.250 F.300.
17.下表为元素周期表中的一部分,表中列出8种元素在周期表中的位置,按要求回答下列问题.
(1)在①~⑧元素中化学性质最不活泼的元素的名称是氩,金属性最强的元素的名称是钠.
(2)③、④、⑥三种元素中的原子半径最小的是O(填元素符号).
(3)①、②、③三种元素形成的离子,离子半径由大到小的顺序是Na+>Mg2+>Al3+(用离子符号填写).
(4)④与⑥形成的化合物的电子式为 .
.
(5)④与氢形成含氢量最高的化合物的结构式 .
.
(6)写出①和③两种元素的最高价氧化物对应的水化物相互反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(7)写出①、⑥和氢元素形成既含离子键又含共价键的化合物的电子式: ,形成的晶体是离子晶体.
,形成的晶体是离子晶体.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ④ | ⑥ | ||||||
| 3 | ① | ② | ③ | ⑤ | ⑦ | ⑧ |
(2)③、④、⑥三种元素中的原子半径最小的是O(填元素符号).
(3)①、②、③三种元素形成的离子,离子半径由大到小的顺序是Na+>Mg2+>Al3+(用离子符号填写).
(4)④与⑥形成的化合物的电子式为
 .
.(5)④与氢形成含氢量最高的化合物的结构式
 .
.(6)写出①和③两种元素的最高价氧化物对应的水化物相互反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(7)写出①、⑥和氢元素形成既含离子键又含共价键的化合物的电子式:
 ,形成的晶体是离子晶体.
,形成的晶体是离子晶体.
14.除去下列物质中少量杂质(括号内为杂质),所用试剂或方法错误的是( )
| A. | NaCl固体(KNO3)溶解配成热饱和溶液、降温结晶 | |
| B. | CO(水蒸气)通过浓硫酸的洗气瓶 | |
| C. | CaO固体(CaCO3)高温煅烧 | |
| D. | KCl固体(MnO2)溶解、过滤、蒸发 |
11.已知在101kPa,25℃条件下,2mol氢气燃烧生成水蒸气放出484kJ的热量,下列热化学方程式正确的是( )
| A. | H2O(g)=H2(g)+$\frac{1}{2}$ O2(g)△H=+242 kJ/mol | B. | 2H2(g)+O2(g)=2H2O (l)△H=-484 kJ/mol | ||
| C. | H2(g)+$\frac{1}{2}$ O2(g)=H2O (g)△H=-242 kJ | D. | 2H2(g)+O2(g)=2H2O (g)△H=+484 kJ/mol |
12.下列说法正确的是( )
| A. | 1molOH-的质量是17g/mol | |
| B. | CO2的摩尔质量是44 | |
| C. | 标况下气体的摩尔体积是22.4L | |
| D. | 12gC-12中含的C原子数是阿伏伽德罗常数 |
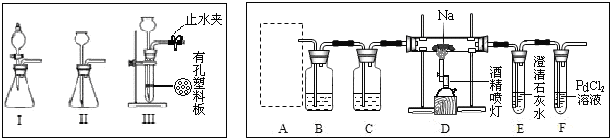
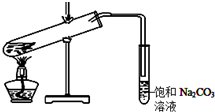 某学生做乙酸乙酯的制备实验装置如图所示.
某学生做乙酸乙酯的制备实验装置如图所示.