题目内容
14.根据价层电子对判断下列分子或者离子的空间构型是平面正三角形的是( )| A. | NH3 | B. | CF4 | C. | H2S | D. | CO32- |
分析 根据价层电子对互斥理论确定其空间构型,价层电子对数=σ 键个数+$\frac{1}{2}$(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数,据此分析解答.
解答 解:A.NH3分子中,N的价层电子对个数=3+$\frac{1}{2}$(5-1×3)=4,所以N原子采取sp3杂化,含有一个孤电子对,故空间结构为三角锥形,故A错误;
B.CF4中C的价层电子对个数=4+$\frac{1}{2}$(4-1-4×1)=4,所以CF4中C原子采取sp3杂化,故空间结构为正四面体,故B错误;
C.H2S分子中,中心S原子价层电子对个数=2+$\frac{1}{2}$×(6-2×1)=4,含有2个孤电子对,采取sp3杂化,空间结构为V形,故C错误;
D.CO32-中价层电子对个数=3+$\frac{1}{2}$(4+2-3×2)=3,所以CO32-中C原子采取sp2杂化,空间结构为平面正三角形,故D正确;
故选D.
点评 本题考查了粒子空间构型的判断,根据价层电子对互斥理论来分析解答即可,该知识点为考试热点,要熟练掌握方法、技巧,难点是孤电子对个数的计算方法,题目难度不大.

练习册系列答案
相关题目
5.下列关于Na2O2的叙述正确的是( )
| A. | Na2O2是淡黄色固体,久置于空气中变成Na2O | |
| B. | Na2O2与水的反应中,Na2O2只作氧化剂 | |
| C. | 用0.1mol Na2O2与足量水反应转移的电子的物质的量为0.2mol | |
| D. | Na2O2放入饱和NaOH溶液中,放出大量的O2,并有白色固体析出 |
2.《中华人民共和国大气污染防治法》于2016年1月1日起实施.为保护和改善大气环境,下列做法不应该提倡的是( )
| A. | 开发生物质能替代化石燃料 | B. | 向高空排放金属冶炼产生的粉尘 | ||
| C. | 用催化转化技术处理汽车尾气 | D. | 大力推广生产和使用无氟冰箱 |
9.(1)在短周期主族元素中,氯及其相邻两元素的电负性由大到小的顺序是F>Cl>S(用元素符号表示)
(2)A、B、C为同一短周期金属元素.依据下表数据分析,C元素在化合物中的主要化合价为+3;A、B、C三种元素的原子半径由大到小的顺序是A>B>C.
(3)已知过氧化氢分子的空间结构如图所示,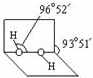 分子中氧原子采取sp3杂化;通常情况下,H2O2与水任意比互溶的主要原因是H2O2分子与水分子间形成氢键,使H2O2与水任意比互溶.
分子中氧原子采取sp3杂化;通常情况下,H2O2与水任意比互溶的主要原因是H2O2分子与水分子间形成氢键,使H2O2与水任意比互溶.
(4)R是1~36号元素中未成对电子数最多的原子.R3+在溶液中存在如下转化:
R3+$?_{H+}^{OH-}$R(OH)3$?_{H+}^{OH-}$[R(OH)4]-
①基态R原子的价电子排布式为3d54s1.
②[R(OH)4]-中存在的化学键是BD.
A.离子键 B.极性键 C.非极性键 D.配位键
(5)等电子体原理可广义理解为:重原子数相等(重原子指原子序数≥4的原子),总电子数或价电子数相等的分子或离子.若将H2O2滴入液氨中,可得白色固体A,红外光谱显示,A中有阴阳两种离子,阳离子是正四面体,阴离子与H2O2互为等电子体.则A的结构简式为NH4OOH.
(2)A、B、C为同一短周期金属元素.依据下表数据分析,C元素在化合物中的主要化合价为+3;A、B、C三种元素的原子半径由大到小的顺序是A>B>C.
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 500 | 4600 | 6900 | 9500 |
| B | 740 | 1500 | 7700 | 10500 |
| C | 580 | 1800 | 2700 | 11600 |
 分子中氧原子采取sp3杂化;通常情况下,H2O2与水任意比互溶的主要原因是H2O2分子与水分子间形成氢键,使H2O2与水任意比互溶.
分子中氧原子采取sp3杂化;通常情况下,H2O2与水任意比互溶的主要原因是H2O2分子与水分子间形成氢键,使H2O2与水任意比互溶.(4)R是1~36号元素中未成对电子数最多的原子.R3+在溶液中存在如下转化:
R3+$?_{H+}^{OH-}$R(OH)3$?_{H+}^{OH-}$[R(OH)4]-
①基态R原子的价电子排布式为3d54s1.
②[R(OH)4]-中存在的化学键是BD.
A.离子键 B.极性键 C.非极性键 D.配位键
(5)等电子体原理可广义理解为:重原子数相等(重原子指原子序数≥4的原子),总电子数或价电子数相等的分子或离子.若将H2O2滴入液氨中,可得白色固体A,红外光谱显示,A中有阴阳两种离子,阳离子是正四面体,阴离子与H2O2互为等电子体.则A的结构简式为NH4OOH.
6.短周期元素甲、乙、丙、丁的原子序数依次增大,甲位于第VA族,乙原子的核外电子数比甲原子多1,乙与丁同族,丙原子最外层电子数与电子层数相等.下列判断正确的是( )
| A. | 离子半径:丁>丙>乙 | |
| B. | 81号元素铊与丙元素处同主族,则铊的最高价氧化物对应水化物呈两性 | |
| C. | 电解法可以用乙与丙形成的化合物制得丙单质 | |
| D. | 同周期元素中丁的最高价氧化物对应水化物的酸性最强 |