题目内容
18.下列化学用语完全正确的一组是( )| A. | 电子式:次氯酸: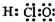 ;过氧化钠: ;过氧化钠: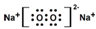 ;羟基: ;羟基: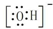 | |
| B. | KHSO4熔融电离:KHSO4=K++H++SO42-;KHCO3溶解于水:KHCO3=K++H++CO32- | |
| C. | 高聚物化学式:聚异戊二烯: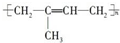 ;PVC: ;PVC: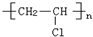 ;PE: ;PE: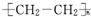 | |
| D. | 下列分子式代表的有机物均有可能与NaHCO3反应放出CO2:C5H12O2、C2H4O2、C7H8O |
分析 A、HClO为共价化合物,分子中存在1个氧氢键和1个Cl-O键;-OH不显电性;
B、共价键在熔融状态下不能被断裂;HCO3-是弱酸根,在溶液中不能完全电离;
C、异戊二烯在加聚时,两条双键均打开,在2号和3号碳原子间新形成一条双键;聚氯乙烯俗称PVC;聚乙烯俗称PE;
D、只有羧基才能与碳酸氢钠反应放出二氧化碳.
解答 解:A、HClO为共价化合物,分子中存在1个氧氢键和1个Cl-O键,次氯酸的电子式为: ;-OH不显电性,故电子式为
;-OH不显电性,故电子式为 ,故A错误;
,故A错误;
B、共价键在熔融状态下不能被断裂,故KHSO4熔融电离:KHSO4=K++HSO4-;HCO3-是弱酸根,在溶液中不能完全电离,故KHCO3在水溶液中只能完全电离为钾离子和碳酸氢根,即电离方程式为:KHCO3=K++HCO3-,故B错误;
C、异戊二烯在加聚时,两条双键均打开,在2号和3号碳原子间新形成一条双键,故聚异戊二烯的结构简式为 ;聚氯乙烯俗称PVC,由氯乙烯加聚而来,故结构简式为
;聚氯乙烯俗称PVC,由氯乙烯加聚而来,故结构简式为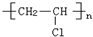 ;聚乙烯俗称PE,由乙烯加聚而来,故结构简式为
;聚乙烯俗称PE,由乙烯加聚而来,故结构简式为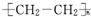 ,故C正确;
,故C正确;
D、C5H12O2一定不是羧酸类,故一定不能和碳酸氢钠反应生成二氧化碳;C7H8O可能为苯甲醇,还可能为邻、间、对甲基苯酚,但无论是哪种,均不能和碳酸氢钠反应生成二氧化碳,故D错误.
故选C.
点评 本题综合考查了常见化合物的电子式、电解质在水溶液中和熔融状态下的电离方程式以及有机物的结构,应注意的是共价键在水溶液中可能断裂,在熔融状态下一定不能断裂.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
8.关于氯水的叙述不正确的是( )
| A. | 氯气和液氯是两种不同物质 | |
| B. | 新制氯水溶液中存在两个平衡状态 | |
| C. | 久置的氯水,溶液的PH会变小 | |
| D. | 向氯水中滴加紫色石蕊试剂,溶液先变红后褪色 |
9.下列说法不正确的是( )
| A. | 浓硝酸与足量铜片反应时,先生成红棕色气体,后生成无色气体 | |
| B. | 氧化铝的熔点很高,可用于制造熔融烧碱的坩埚 | |
| C. | 在含FeC12杂质的FeCl3溶液中通入足量C12后,充分加热除去过量的C12,不能得到纯净的FeC13溶液 | |
| D. | 饱和氯水既有酸性又有漂白性,加入适量NaHCO3固体,其漂白性增强 |
3.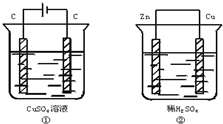 如图两个装置中,溶液体积均为200mL,开始时电解质溶液的浓度均为0.1mol•L-1,工作一段时间后,测得导线上通过0.02mol电子,若不考虑盐水解和溶液体积的变化,则下列叙述正确的是( )
如图两个装置中,溶液体积均为200mL,开始时电解质溶液的浓度均为0.1mol•L-1,工作一段时间后,测得导线上通过0.02mol电子,若不考虑盐水解和溶液体积的变化,则下列叙述正确的是( )
 如图两个装置中,溶液体积均为200mL,开始时电解质溶液的浓度均为0.1mol•L-1,工作一段时间后,测得导线上通过0.02mol电子,若不考虑盐水解和溶液体积的变化,则下列叙述正确的是( )
如图两个装置中,溶液体积均为200mL,开始时电解质溶液的浓度均为0.1mol•L-1,工作一段时间后,测得导线上通过0.02mol电子,若不考虑盐水解和溶液体积的变化,则下列叙述正确的是( )| A. | 产生气体的体积:①>② | |
| B. | 电极总质量的变化:①增加,②减小 | |
| C. | 溶液的pH变化:①增大,②减小 | |
| D. | 电极反应式:①装置中的阳极:4OH--4e-→2H2O+O2↑ ②装置中的负极:2H++2e-→H2↑ |
10.用活性炭还原法处理氮氧化物.有关反应为C(s)+2NO(g)?N2(g)+CO2(g).某研究小组向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
(1)10~20min以v(CO2)表示的反应速率为0.009 mol•L-1•min-1.
(2)根据表中数据,计算T℃时该反应的平衡常数为0.56(保留两位小数).
(3)下列各项能作为判断该反应达到平衡标志的是CD(填序号字母).
A.容器内压强保持不变 B.2v正(NO)=v逆(N2)
C.容器内CO2的体积分数不变 D.混合气体的密度保持不变
(4)30min时改变某一条件,反应重新达到平衡,则改变的条件可能是分离出了二氧化碳(减小CO2的浓度).
(5)一定温度下,随着NO的起始浓度增大,则NO的平衡转化率不变(填“增大”“不变”或“减小”).
| 物质浓度(mol/L)时间(min) | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
(2)根据表中数据,计算T℃时该反应的平衡常数为0.56(保留两位小数).
(3)下列各项能作为判断该反应达到平衡标志的是CD(填序号字母).
A.容器内压强保持不变 B.2v正(NO)=v逆(N2)
C.容器内CO2的体积分数不变 D.混合气体的密度保持不变
(4)30min时改变某一条件,反应重新达到平衡,则改变的条件可能是分离出了二氧化碳(减小CO2的浓度).
(5)一定温度下,随着NO的起始浓度增大,则NO的平衡转化率不变(填“增大”“不变”或“减小”).
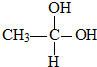 →CH3-CHO+H2O
→CH3-CHO+H2O
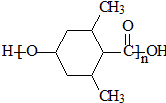 ]
]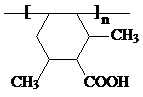 ;
;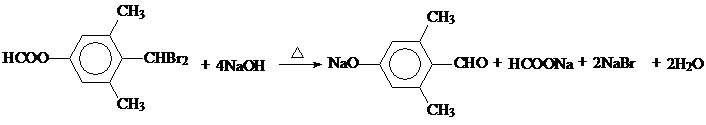 ;
; ;
;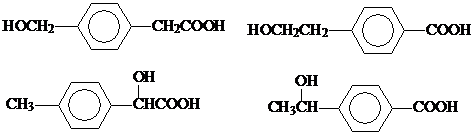 (任写一个).
(任写一个).