题目内容
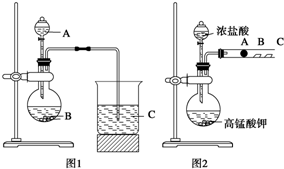 某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律.A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.
某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律.A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.(1)甲同学设计实验的依据是
(2)上述反应的离子方程式分别为
(3)乙同学的实验原理是
考点:非金属在元素周期表中的位置及其性质递变的规律
专题:实验题,元素周期律与元素周期表专题
分析:(1)根据信息知道:甲同学根据元素非金属性与对应最高价含氧酸之间的关系如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较,根据强酸制弱酸来回答即可;
(2)根据发生的反应来书写离子方程式;
(3)根据氧化性强的单质可以将氧化性弱的单质从其盐中置换出来结合反应产物来分析.
(2)根据发生的反应来书写离子方程式;
(3)根据氧化性强的单质可以将氧化性弱的单质从其盐中置换出来结合反应产物来分析.
解答:
解:(1)根据题干信息:甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素非金属性强弱比较的实验研究,硫酸的酸性强于碳酸,碳酸酸性强于硅酸,最高价氧化物对应水化物酸性越强,则原子的非金属性越强,依据强酸制弱酸来设计反应,所以A为硝酸,B为碳酸钙,C为硅酸钠溶液,
故答案为:强酸制弱酸;硝酸;碳酸钙;硅酸钠溶液;
(2)硝酸与碳酸钙反应生成二氧化碳、硝酸钙和水,其反应的离子方程式为:CaCO3+2H+═Ca2++2CO2↑+H2O;二氧化碳与硅酸钠反应生成硅酸沉淀和碳酸钠,其反应的离子方程式为:SiO32-+CO2+H2O═H2SiO3↓+CO32-;
故答案为:CaCO3+2H+═Ca2++2CO2↑+H2O;SiO32-+CO2+H2O═H2SiO3↓+CO32-;
(3)根据题干信息:乙同学设计了如图2装置来验证卤族元素性质的递变规律,所以乙同学的实验原理是活泼的非金属单质置换较不活泼的非金属单质,高锰酸钾和浓盐酸反应会产生氯气,氯气具有氧化性,能将溴离子,碘离子氧化为对应的单质,即A处:Cl2+2Br-=2Cl-+Br2,B:Cl2+2I-=2Cl-+I2,
故答案为:活泼的非金属单质置换较不活泼的非金属单质;Cl2+2I-=2Cl-+I2.
故答案为:强酸制弱酸;硝酸;碳酸钙;硅酸钠溶液;
(2)硝酸与碳酸钙反应生成二氧化碳、硝酸钙和水,其反应的离子方程式为:CaCO3+2H+═Ca2++2CO2↑+H2O;二氧化碳与硅酸钠反应生成硅酸沉淀和碳酸钠,其反应的离子方程式为:SiO32-+CO2+H2O═H2SiO3↓+CO32-;
故答案为:CaCO3+2H+═Ca2++2CO2↑+H2O;SiO32-+CO2+H2O═H2SiO3↓+CO32-;
(3)根据题干信息:乙同学设计了如图2装置来验证卤族元素性质的递变规律,所以乙同学的实验原理是活泼的非金属单质置换较不活泼的非金属单质,高锰酸钾和浓盐酸反应会产生氯气,氯气具有氧化性,能将溴离子,碘离子氧化为对应的单质,即A处:Cl2+2Br-=2Cl-+Br2,B:Cl2+2I-=2Cl-+I2,
故答案为:活泼的非金属单质置换较不活泼的非金属单质;Cl2+2I-=2Cl-+I2.
点评:本题将元素及其化合物、元素周期律与非金属性强弱比较的实验设计结合起来,具有较强的综合性,有一定的难度,注意实验设计的原理和方法.

练习册系列答案
相关题目
“低碳经济”是以低能耗、低污染、低排放为基础的可持续发展的经济模式.下列说法与“低碳经济”不符合的是( )
| A、采用压缩天然气代替燃油 |
| B、加快化石燃料的开采与使用,提高人们的生活水平 |
| C、利用硅材料制成光伏发电装置发电 |
| D、利用太阳能、风能等,减少化石燃料的使用 |
西维因是一种高效低毒杀虫剂,在碱性条件下可水解:

有关说法正确的是( )

有关说法正确的是( )
| A、西维因分子式为C12H10NO2 |
| B、西维因分子中至少有21个原子共平面 |
| C、水解后的两种有机产物,各有一种官能团 |
| D、反应后的溶液经酸化,不可用FeCl3溶液检验西维因是否已经发生水解 |
