题目内容
已知实验室用二氧化锰与浓盐酸反应来制取氯气.现有足量的浓盐酸,与一定量的二氧化锰反应,收集到标准状况下氯气为4.48L.再把收集到的氯气全部通入100mL的溴化亚铁溶液中,有一半的溴离子被氧化,请回答下列问题.
(1)写出制氯气的离子方程式;
(2)被氧化盐酸的物质的量;
(3)原溴化亚铁的物质的量浓度.
(1)写出制氯气的离子方程式;
(2)被氧化盐酸的物质的量;
(3)原溴化亚铁的物质的量浓度.
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:n(Cl2)=
=0.2mol,二氧化锰与足量的浓盐酸反应:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,在反应中,盐酸不全部被氧化,部分表现为酸性,结合反应的化学方程式计算.
| 4.48L |
| 22.4L/mol |
| ||
解答:
解:(1)二氧化锰与足量的浓盐酸反应的化学方程式为MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,则离子方程式为MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,
答:制氯气的离子方程式为MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;?
(2)n(Cl2)=
=0.2mol,根据化合价的变化可知,在MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O反应中,当有4molHCl参加反应时,有2molHCl被氧化,则
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O 被氧化的HCl
1mol 2mol
0.1mol 0.2mol
生成0.2mol氯气,应有0.4molHCl被氧化,
答:被氧化盐酸的物质的量为0.4mol;
(3)已知:还原性强弱:Fe2+>Br-,再把收集到的氯气全部通入100mL的溴化亚铁溶液中,有一半的溴离子被氧化,则Fe2+应全部被氧化,
设原溴化亚铁的物质的量浓度为cmol/L.
氧化还原反应中得失电子数相等得:0.1c+0.1c×2×
=0.2×2,
c=0.2,
答:原溴化亚铁的物质的量浓度为2mol/L.
| ||
| ||
答:制氯气的离子方程式为MnO2+4H++2Cl-
| ||
(2)n(Cl2)=
| 4.48L |
| 22.4L/mol |
| ||
MnO2+4HCl(浓)
| ||
1mol 2mol
0.1mol 0.2mol
生成0.2mol氯气,应有0.4molHCl被氧化,
答:被氧化盐酸的物质的量为0.4mol;
(3)已知:还原性强弱:Fe2+>Br-,再把收集到的氯气全部通入100mL的溴化亚铁溶液中,有一半的溴离子被氧化,则Fe2+应全部被氧化,
设原溴化亚铁的物质的量浓度为cmol/L.
氧化还原反应中得失电子数相等得:0.1c+0.1c×2×
| 1 |
| 2 |
c=0.2,
答:原溴化亚铁的物质的量浓度为2mol/L.
点评:本题考查氯气的性质和氧化还原反应的计算,题目难度不大,注意根据反应的化学方程式计算,本题中要特别注意参加反应的盐酸与被氧化的盐酸的物质的量的关系.

练习册系列答案
相关题目
下列各物质中化学键类型完全相同的是( )
| A、Na2O2和NaOH |
| B、KClO和HClO |
| C、CO2和H2O2 |
| D、CCl4和H2O |
下列行为不符合“促进低碳经济”宗旨的是( )
| A、尽量使用含12C的产品,减少使用含13C或14C的产品 |
| B、发展水电,开发新能源,如核能、太阳能、风能等,减少对矿物能源的依赖 |
| C、推广煤的干馏、气化、液化技术,提供清洁、高效燃料和基础化工原料 |
| D、推广利用微生物发酵技术,将植物桔杆、动物粪便等制成沼气以替代液化石油气 |
科学家根据元素周期律和原子结构理论预测出原子序数为114的元素的存在,下面关于它的原子结构和性质预测不正确的是( )
| A、该元素原子的最外层电子数为4 |
| B、其常见价态为+2、+4 |
| C、它的金属性比铅强 |
| D、它的原子半径比第115号元素的原子半径小 |
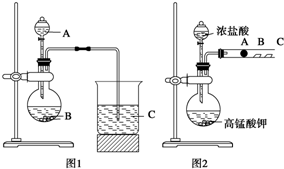 某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律.A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.
某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律.A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气. 如图为相互串联的甲乙两个电解池,请回答:
如图为相互串联的甲乙两个电解池,请回答: