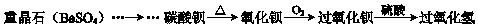题目内容
7.把pOH定义为pOH=-lgc(OH-),则弱碱溶液中c(OH-)可表示为( )| A. | $\frac{{K}_{W}}{pOH}$ | B. | 10pH | C. | 10-pH | D. | 10pH-14 |
分析 由于水的离子积Kw=c(OH-)•c(H+)=10-14,而c(OH-)=10-pOH,c(H+)=10-pH,据此分析计算.
解答 解:由于水的离子积Kw=c(OH-)•c(H+)=10-14,而pOH定义为pOH=-lgc(OH-),则c(OH-)=10-pOH,c(H+)=10-pH,故有:10-pOH×10-pH=10-14,则pOH+pH=14,即pOH=14-pH,而c(OH-)=10-pOH,故有:c(OH-)=10pH-14,故选D.
点评 本题考查了pH和pOH的相关计算,对公式的灵活运用是解题关键,难度不大.

练习册系列答案
相关题目
10.下列有关仪器使用方法或实验操作正确的是( )
| A. | 可以用酒精灯直接加热锥形瓶和容量瓶 | |
| B. | 用容量瓶配溶液时,若加水超过刻度线,立即用滴管吸出多余液体 | |
| C. | 蒸馏时温度计水银球应高于蒸馏烧瓶支管口 | |
| D. | 振荡分液漏斗时应关闭其玻璃塞和活塞 |
2.( )和下列离子方程式相对应的化学方程式正确的是.
| A. | Zn2++2OH-=Zn(OH)2↓ ZnCO3+2NaOH=Zn(OH)2↓+Na2CO3 | |
| B. | Ba2++SO42-=BaSO4↓ Ba(OH)2+H2SO4=BaSO4↓+2H2O | |
| C. | Ag++Cl-=AgCl↓ AgNO3+KCl=AgCl↓+KNO3 | |
| D. | Cu+2Ag+=Cu2++2Ag↓ Cu+2AgCl=2Ag+CuCl2 |
19.向某酸X的溶液中加人CaCO3固体.发生化学反应且生成CO2气体,下列叙述正确的是( )
| A. | CaCO3是弱电解质 | B. | CO2是弱电解质 | ||
| C. | 酸X一定是共价化合物 | D. | 酸X一定是强电解质 |
16.下列转化不能一步实现的是( )
| A. | Al→NaAlO2 | B. | Fe→Fe3O4 | C. | S→SO3 | D. | Si→SiO2 |
 “大象牙膏”的实验操作是向30%的过氧化氢溶液中加入少量二氧化锰和表面活性剂,现象如图.
“大象牙膏”的实验操作是向30%的过氧化氢溶液中加入少量二氧化锰和表面活性剂,现象如图.