题目内容
25℃时,将体积为Va、pH=a的某一元酸与体积Vb、pH=b的某一元碱混合,请完成下题.
(1)若a+b=14,2Va=Vb,碱是NaOH,反应后所得溶液pH小于7.由此你能得到的结论是 .
(2)若a+b=13,酸是盐酸,碱是KOH,现用盐酸滴定50.00mL KOH溶液,当滴定到溶液的pH=2时,消耗盐酸11.11mL.则b= .
(3)若已知Va<Vb和a=0.5b,酸是强酸,碱是强碱,酸和碱恰好中和,则a的取值范围是 .
(1)若a+b=14,2Va=Vb,碱是NaOH,反应后所得溶液pH小于7.由此你能得到的结论是
(2)若a+b=13,酸是盐酸,碱是KOH,现用盐酸滴定50.00mL KOH溶液,当滴定到溶液的pH=2时,消耗盐酸11.11mL.则b=
(3)若已知Va<Vb和a=0.5b,酸是强酸,碱是强碱,酸和碱恰好中和,则a的取值范围是
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:(1)酸中c(H+)=10-pH mol?L-1=10-amol?L-1,碱中c(OH-)=10pH-14 mol?L-1=10b-14 mol?L-1=10-amol?L-1,可见酸中c(H+)与碱中c(OH-)相等,2Va=Vb混合后溶液的pH小于7,说明溶液呈酸性,应为弱酸与强碱的组合;
(2)酸中c(H+)=10-pH mol?L-1=10-amol?L-1,碱中c(OH-)=10pH-14 mol?L-1=10b-14 mol?L-1=10-(a+1)mol?L-1,据滴定过程中,氢离子浓度=
计算.
(3)pH=a的强酸c(H+)=10-amol/L,pH=b的强碱c(OH-)=10b-14mol/L,恰好中和,则有Va×10-a=Vb×10b-14,结合Va<Vb,a=0.5b计算.
(2)酸中c(H+)=10-pH mol?L-1=10-amol?L-1,碱中c(OH-)=10pH-14 mol?L-1=10b-14 mol?L-1=10-(a+1)mol?L-1,据滴定过程中,氢离子浓度=
| n(氢离子) |
| V(溶液) |
(3)pH=a的强酸c(H+)=10-amol/L,pH=b的强碱c(OH-)=10b-14mol/L,恰好中和,则有Va×10-a=Vb×10b-14,结合Va<Vb,a=0.5b计算.
解答:
解:(1)解:pH=a的酸的溶液中c(H+)=10-pH mol?L-1=10-amol?L-1,
a+b=14,则pH=b的碱中c(OH-)=10pH-14 mol?L-1=10b-14 mol?L-1=10-amol?L-1,
可见酸中c(H+)与碱中c(OH-)相等,2Va=Vb混合后溶液的pH小于7,说明溶液呈酸性,应为弱酸与强碱的组合,故答案为:酸是一种弱酸;
(2)酸中c(H+)=10-pH mol?L-1=10-amol?L-1,碱中c(OH-)=10pH-14 mol?L-1=10b-14 mol?L-1=10-(a+1)mol?L-1,pH=2时,c(H+)=10-2mol/L=
,解得,a=1,所以,b=12,故答案为:12;
(3)pH=b的某一元强碱溶液呈碱性,则b>7,
a=0.5b,则a>0.5×7=3.5,即a>
;
pH=a的强酸c(H+)=10-amol/L,pH=b的强碱c(OH-)=10b-14mol/L,恰好中和,则有Va×10-a=Vb×10b-14,
可得:
=10a+b-14,
Va<Vb,
则10a+b-14<1,
a+b<14,
又a=0.5b,
则a+2a<14,
3a<14,
a<
,
所以:
<a<
,故答案为:
<a<
.
a+b=14,则pH=b的碱中c(OH-)=10pH-14 mol?L-1=10b-14 mol?L-1=10-amol?L-1,
可见酸中c(H+)与碱中c(OH-)相等,2Va=Vb混合后溶液的pH小于7,说明溶液呈酸性,应为弱酸与强碱的组合,故答案为:酸是一种弱酸;
(2)酸中c(H+)=10-pH mol?L-1=10-amol?L-1,碱中c(OH-)=10pH-14 mol?L-1=10b-14 mol?L-1=10-(a+1)mol?L-1,pH=2时,c(H+)=10-2mol/L=
| 10-amol/L×1.111×10-2-10-(a+1)mol/L×5×10-2 |
| 1.111×10-2L+5×10-2L |
(3)pH=b的某一元强碱溶液呈碱性,则b>7,
a=0.5b,则a>0.5×7=3.5,即a>
| 7 |
| 2 |
pH=a的强酸c(H+)=10-amol/L,pH=b的强碱c(OH-)=10b-14mol/L,恰好中和,则有Va×10-a=Vb×10b-14,
可得:
| Va |
| Vb |
Va<Vb,
则10a+b-14<1,
a+b<14,
又a=0.5b,
则a+2a<14,
3a<14,
a<
| 14 |
| 3 |
所以:
| 7 |
| 2 |
| 14 |
| 3 |
| 7 |
| 2 |
| 14 |
| 3 |
点评:本题考查了pH的相关计算,题目难度中等,注意混合溶液中pH的计算.

练习册系列答案
相关题目
下列反应是氧化还原反应且水作还原剂的是( )
| A、2Na+2H2O=2NaOH+H2↑ | ||||
B、C+H2O(g)
| ||||
| C、2F2+2H2O=4HF+O2 | ||||
| D、3NO2+H2O=2HNO3+NO |
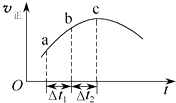 向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )
向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )| A、反应物的总能量低于生成物的总能量 |
| B、反应物浓度:a点小于b点 |
| C、△t1=△t2时,SO2的转化率:a~b段小于b~c段 |
| D、反应在c点达到平衡状态 |
下列各组原子,彼此性质一定相似的是( )
| A、价电子排布为1s2与2s2的元素 |
| B、M层上有两个电子与N层上有两个电子的元素 |
| C、2p上有一个未成对电子与3p上有一个未成对电子的元素 |
| D、L层的p轨道上有一个空轨道和M层的p轨道上有一个空轨道的元素 |
