题目内容
150℃、101kPa时,由两种烃组成的混合气体0.5L在4.5LO2(足量)中完全燃烧,测得反应后气体总体积小于5L,其中含CO2 0.8L.
(1)求此混合气体中两种烃的分子式
(2)求此混合气体中两种烃的体积比.
(3)求生成水蒸汽的体积.
(1)求此混合气体中两种烃的分子式
(2)求此混合气体中两种烃的体积比.
(3)求生成水蒸汽的体积.
考点:有关有机物分子式确定的计算
专题:
分析:先根据烃的燃烧通式及反应后气体体积减小确定混合烃中平均氢原子数,再根据0.5L混合烃生成了0.8L二氧化碳计算出混合烃中平均碳原子数,根据计算结果可知一定含有甲烷,再根据平均氢原子数得出一定为甲烷和乙炔的混合物,然后根据混合烃的平均碳原子数计算出二者的体积之比,最后根据燃烧的关系式及氢原子守恒CH4~2H2O、C2H2~H2O计算出生成水蒸气的体积.
解答:
解:(1)设该混合烃平均化学式为CxHy,则:
CxHy+(x+
)O2=xCO2+
H2O
150℃时水为气体,要使反应后体积小于5L,则有该反应各气体物质的系数关系为:
1+x+
>x+
解得:y<4,
0.5L混合烃产生0.8LCO2,相同条件下气体的物质的量之比等于其体积之比,
则0.5mol混合烃污染燃烧生成0.8mol二氧化碳,1mol混合烃完全燃烧生成1.6mol二氧化碳,则x=1.6;由此可知混合烃中必有甲烷(CH4),另一种烃氢数一定小于4,氢原子数小于4的烃只有乙炔(C2H2),
答:此混合气体中两种烃的分子式为CH4和C2H2;
(2)设含有xmol甲烷、ymol乙炔,
根据碳原子守恒看得:
=1.6,
解得:x:y=2:3,即:甲烷与乙炔物质的量之比为2:3,
答:此混合气体中甲烷与乙炔物质的量之比为2:3;
(3)相同条件下体积之比就等于物质的量之比,则混合气体中甲烷的体积为:0.5L×
=0.2L,乙炔的物质的量为:0.5L×
=0.3L,
根据氢原子守恒看得关系式:CH4~2H2O、C2H2~H2O,
1 2 1 1
0.2L 0.4L 0.3L 0.3L
则生成水的体积为:0.4L+0.3L=0.7L,
答:生成水蒸汽的体积为0.7L.
CxHy+(x+
| y |
| 4 |
| y |
| 2 |
150℃时水为气体,要使反应后体积小于5L,则有该反应各气体物质的系数关系为:
1+x+
| y |
| 4 |
| y |
| 2 |
0.5L混合烃产生0.8LCO2,相同条件下气体的物质的量之比等于其体积之比,
则0.5mol混合烃污染燃烧生成0.8mol二氧化碳,1mol混合烃完全燃烧生成1.6mol二氧化碳,则x=1.6;由此可知混合烃中必有甲烷(CH4),另一种烃氢数一定小于4,氢原子数小于4的烃只有乙炔(C2H2),
答:此混合气体中两种烃的分子式为CH4和C2H2;
(2)设含有xmol甲烷、ymol乙炔,
根据碳原子守恒看得:
| xmol×1+ymol×2 |
| xmol+ymol |
解得:x:y=2:3,即:甲烷与乙炔物质的量之比为2:3,
答:此混合气体中甲烷与乙炔物质的量之比为2:3;
(3)相同条件下体积之比就等于物质的量之比,则混合气体中甲烷的体积为:0.5L×
| 2 |
| 3+2 |
| 2 |
| 2+3 |
根据氢原子守恒看得关系式:CH4~2H2O、C2H2~H2O,
1 2 1 1
0.2L 0.4L 0.3L 0.3L
则生成水的体积为:0.4L+0.3L=0.7L,
答:生成水蒸汽的体积为0.7L.
点评:本题考查了混合烃燃烧的计算,题目难度中等,注意掌握烃的燃烧通式,能够根据反应前后气体体积不会判断混合烃中氢原子数的范围,经过对混合烃的平均分子式的讨论得出混合物为甲烷和乙炔为解答本题的关键.

练习册系列答案
相关题目
下列各项叙述正确的是( )
| A、由同种元素组成的物质肯定属于纯净物 |
| B、具有相同质子数的微粒都属于同种元素 |
| C、一种元素可有多种离子,但只有一种电中性的原子 |
| D、含有离子键的化合物一定是离子化合物. |
下列分子的中心原子形成sp2杂化轨道的是( )
| A、H2O |
| B、NH3 |
| C、C2H4 |
| D、BeCl2 |
实验室从碘水中提取碘的主要操作,正确的是( )
| A、蒸馏 | B、过滤 | C、分液 | D、萃取 |
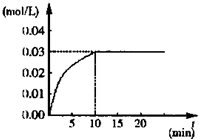 在某一容积为5L的密闭容器内,加入3mol的CO和0.3mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H>0,反应中CO2的浓度随时间变化情况如图:
在某一容积为5L的密闭容器内,加入3mol的CO和0.3mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H>0,反应中CO2的浓度随时间变化情况如图:
