题目内容
6.E、F、G三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4S1.①E、F、G三元素的元素符号分别为K、Cr、Cu.
②F元素在其化合物中最高化合价为+6.
③G2+离子的核外电子排布式为1s22s22p63s23p63d9或[Ar]3d9.G2+和N分子形成的配离子的结构式为
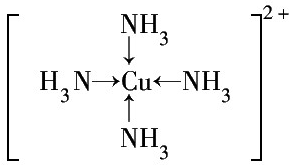 .
.
分析 E、F、G三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4S1,所以E、F、G分别为钾、铬、铜,由此分析解答.
解答 解:E、F、G分别为钾、铬、铜.
①由上述分析可知,分别为K、Cr、Cu,故答案为:K、Cr、Cu;
②铬元素的价电子排布式为3d54s1,故其化合物中最高化合价为+6价,故答案为:+6;
③基态Cu的核外电子排布式为为[Ar]3d104s1,故Cu2+离子的核外电子排布式为[Ar]3d9,Cu2+和NH3分子形成的配离子为[Cu(NH3)4]2+,其结构式为 ,故答案为:1s22s22p63s23p63d9或[Ar]3d9;
,故答案为:1s22s22p63s23p63d9或[Ar]3d9; .
.
点评 本题考查原子结构与元素周期律,为高频考点,把握电子排布等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
16.铝土矿的主要成分是Al2O3、SiO2和Fe2O3等.从铝土矿中提炼Al2O3的流程如下:

下列说法中错误的是( )

下列说法中错误的是( )
| A. | 滤液I的主要成分是Na2SiO3、NaAlO2和NaOH | |
| B. | 滤液III的含大量的阴离子是HCO3- | |
| C. | 反应Y的离子方程式是2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| D. | 滤液II中通入过量的X的目的是使AlO2-充分沉淀而不引进杂质 |
17.屠呦呦因发现了青蒿素这种抗疟良药而获得2015年诺贝尔奖,这充分说明了“化学让人们生活更美好”.下列不属于化学反应在生活中的应用的是( )
| A. | 将氧化铁添加到油漆中制红色油漆 | B. | 用氯气给自来水消毒 | ||
| C. | 将粘土烧制成精美的瓷器 | D. | 用食醋清洗水壶中的水垢 |
14.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 常温下,0.1mol•L-1的碳酸钠溶液中含有的阴离子数大于0.1NA | |
| B. | 标况下33.6mL氯气通入足量水中发生反应,转移电子数为1.5×10-3NA | |
| C. | 常温常压下,28克由C3H6和C4H8组成的混合气体中含共用电子对数目为6NA个 | |
| D. | 同温下,pH=1体积为1L的硫酸溶液所含氢离子数与pH=13体积为1L的氢氧化钠溶液所含氢氧根离子数均为0.1NA |
1.下列关于有机物的说法正确的是( )
| A. |  的分子式为C7H12O 的分子式为C7H12O | |
| B. |  的所有原子一定在同一平面上 的所有原子一定在同一平面上 | |
| C. |  能发生还原反应、氧化反应和取代反应 能发生还原反应、氧化反应和取代反应 | |
| D. |  的二氯代物有15种 的二氯代物有15种 |
11.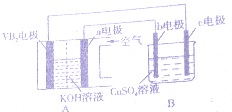 碱性硼化钒(VB2),-空气电池工作时反应为:4VB2+1lO2=4B203+2V205.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到 0.448L气体(标推状况)下列说法正确的是( )
碱性硼化钒(VB2),-空气电池工作时反应为:4VB2+1lO2=4B203+2V205.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到 0.448L气体(标推状况)下列说法正确的是( )
 碱性硼化钒(VB2),-空气电池工作时反应为:4VB2+1lO2=4B203+2V205.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到 0.448L气体(标推状况)下列说法正确的是( )
碱性硼化钒(VB2),-空气电池工作时反应为:4VB2+1lO2=4B203+2V205.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到 0.448L气体(标推状况)下列说法正确的是( )| A. | VB2电极发生的电极反应为:2VB2+11H20-22e-═V205+2B203+22H+ | |
| B. | 若B装置内液体的体积一直为200mL,则原CuS04溶液浓度为0.05 mol/L | |
| C. | 电解过程中,b电极表面先有红色物质析出,然后有气泡产生 | |
| D. | 外电路中电子由c电极流向VB2电极 |
18.下列说法正确的是,( NA表示阿伏加德罗常数的值)( )
| A. | 在常温常压下,11.2升氯气含有的分子数为0.5NA | |
| B. | 在常温常压下,1摩氦气含有的原子数为2NA | |
| C. | 在常温常压下,32克氧气所含原子数目为2NA | |
| D. | 在同温同压时,相同体积的任何气体单质所含的原子数目相同 |
15.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1mol Na2O2与水完全反应时转移电子的数为2NA | |
| B. | 常温下,100mL 1mol•L-1 Na2CO3溶液中CO${\;}_{3}^{2-}$离子数为0.1NA | |
| C. | 1mol FeCl3与足量水反应转化为氢氧化铁胶体后,其中胶体粒子数为NA | |
| D. | 一定条件下催化分解80g SO3,混合气体中氧原子数为3NA |
16.利用太阳能分解水制氢,若光解0.02mol水,下列说法正确的是( )
| A. | 可生成H2的质量为0.02g | |
| B. | 可生成氢的原子数为2.408×1023个 | |
| C. | 可生成H2的体积为0.224L(标准情况) | |
| D. | 生成H2的量理论上等于0.04mol Na与水反应产生H2的量 |