题目内容
6.下列说法中正确的是( )| A. | 分子中键能越大,键长越长,则分子越稳定 | |
| B. | 元素周期表中的第ⅠA族(除H外)和第ⅦA族元素的原子间可能形成共价键 | |
| C. | 水分子可表示为H-O-H,分子中键角为180° | |
| D. | H-O键键能为463 kJ•mol-1,即18 g H2O分解成H2和O2时,消耗能量为2×463 kJ |
分析 A.分子中键能、键长与分子稳定性的关系;
B.金属和非金属化合可能形成离子键,也可能形成共价键;
C.水是V形分子,分子中键角为104.5°
D.反应中热量变化=反应物的总键能-生成物的总键能.
解答 解:A.分子中键能越大,键长越短,则分子越稳定,故A错误;
B.金属和非金属化合可能形成离子键,也可能形成共价键,故B正确;
C.水是V形分子,分子中键角为104.5°,故C错误;
D.反应中热量变化=反应物的总键能-生成物的总键能,由于不知道H-H和O=O的键能,无法求出吸收的能量,故D错误;
故选B.
点评 本题考查较综合,涉及分子的稳定性、键角、反应热、化学键等知识点,熟练掌握基本概念、基本理论即可解答,题目难度不大.

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
1.下列离子方程式书写不正确的是( )
| A. | 用醋酸溶解碳酸钙:2CH3COOH+CaCO3=2CH3COO-+Ca2++CO2↑+H2O | |
| B. | 碳酸氢钠溶液中加入足量热的氢氧化钠溶液:HCO3-+OH-=CO32-+H2O | |
| C. | 用氯酸钠的酸性溶液与H2O2作用制取ClO2:4ClO3-+4H2O2+4H+=4ClO2↑+3O2↑+6H2O | |
| D. | 用硫酸酸化的桔红色的重铬酸钾(K2Cr2O7)溶液与乙醇作用生成乙酸和草绿色三价铬,用于检测是否酒后驾驶:2Cr2O72-+3C2H5OH+16H+→4Cr3++3CH3COOH+11H2O |
17.某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等),下列分析推理正确的是( )
| 50ml盐酸 | 50ml盐酸 | 50ml盐酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
| A. | 15.7g混合物能恰好与盐酸完全反应 | |
| B. | 根据表中数据不能计算出混合物中NaHCO3的质量分数 | |
| C. | 向50ml盐酸中加入混合物27.6g时,盐酸过量 | |
| D. | 盐酸的物质的量浓度为3.0mol/L |
14.在光照条件下,将CH4和Cl2按质量比16:71混合,充分反应后得到物质的量最多的产物是( )
| A. | CH3Cl | B. | CH2Cl2 | C. | CCl4 | D. | HCl |
15.我国“十二五”规划纲要倡导技术创新,温家宝强调稀土要可持续发展.有人发明:用一种硫酸稀土溶液离子膜可电解氧化铈(Ce2O3)成为Ce4+的溶液.使用离子交换膜将电解槽分隔为阳极室和阴极室.阳极材料是阳极液是酸性的硫酸稀土溶液.阴极液是硫酸或钠、镁、铜、镍、锰、锌等的硫酸盐溶液,或上述盐与硫酸的混和溶液.以附有Ce2O3的材料作阳极通直流电电解时,在阳极室得到含Ce4+溶液.下列有关叙述不正确的是( )
| A. | 阳极反应式为:Ce2O3-2e-+6H+═2Ce4++3H2O | |
| B. | 电解时溶液中的阳离子向阳极移动 | |
| C. | 如果阴极液是稀硫酸,电极反应式为:2H++2e-═H2↑ | |
| D. | 如果阴极液是钠、镁、铜、镍、锰、锌等的硫酸盐溶液,则在阴极室可得到铜、镍、锌、锰等金属合金粉末 |
16.如图是X、Y、Z三种液体的对应近似pH,下列判断不正确的是( )

| A. | X显酸性 | B. | Y一定是水 | ||
| C. | Z可能是碳酸钠溶液 | D. | Z可使石蕊试液变蓝 |
 某CuCl2溶液中可能混有盐酸,向该溶液中逐滴滴入某种碱溶液,产生沉淀的物质的量与加入碱的物质的量关系如图所示.据此推断:
某CuCl2溶液中可能混有盐酸,向该溶液中逐滴滴入某种碱溶液,产生沉淀的物质的量与加入碱的物质的量关系如图所示.据此推断: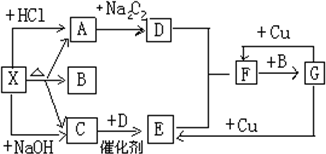 如图中的每一个方格表示有关的一种反应物或生成物,其中X为正盐,A能使澄清石灰水变浑浊的无色气体,C是能使湿润的红色的石蕊试纸变蓝的无色气体,
如图中的每一个方格表示有关的一种反应物或生成物,其中X为正盐,A能使澄清石灰水变浑浊的无色气体,C是能使湿润的红色的石蕊试纸变蓝的无色气体, ,结构式为H-S-H.氮气的电子式为
,结构式为H-S-H.氮气的电子式为 ,结构式为N≡N.氨气的电子式
,结构式为N≡N.氨气的电子式 ,结构式
,结构式 ,空间构型是三角锥.
,空间构型是三角锥.