题目内容
17.下列离子能大量共存的是( )| A. | 使无色酚酞试液呈红色的溶液中:Na+、K+、SO42-、CO32- | |
| B. | 无色透明的溶液中:Cu2+、K+、SO42-、NO3- | |
| C. | 含有大量BaCl2的溶液中:Mg2+、NH4+、SO42-、NO3- | |
| D. | 使紫色石蕊试液呈红色的溶液中:Na+、K+、CO32-、NO3- |
分析 A.使无色酚酞试液呈红色的溶液呈碱性,离子之间不反应且和氢氧根离子不反应的能大量共存;
B.无色溶液中不存在有色离子;
C.含有大量BaCl2的溶液中,离子之间不反应且和BaCl2不反应的能大量共存;
D.使紫色石蕊试液呈红色的溶液呈酸性,离子之间不反应且和氢离子不反应的能大量共存.
解答 解:A.使无色酚酞试液呈红色的溶液呈碱性,这几种离子之间不反应且和氢氧根离子不反应,所以能大量共存,故A正确;
B.无色溶液中不存在有色离子,Cu2+呈蓝色,不符合无色条件,故B错误;
C.含有大量BaCl2的溶液中,Ba2+、SO42-反应生成白色硫酸钡沉淀,所以不能大量共存,故C错误;
D.使紫色石蕊试液呈红色的溶液呈酸性,H+、CO32-反应生成二氧化碳和水而不能大量共存,故D错误;
故选A.
点评 本题考查离子共存,为高频考点,明确离子性质及离子共存条件是解本题关键,侧重考查复分解反应,注意题干中限制性条件,知道常见有色离子,注意隐含条件的挖掘,题目难度不大.

练习册系列答案
相关题目
7.下列情况不能用勒夏特列原理解释的是( )
| A. | 利用饱和NaCl溶液除去Cl2中的HCl | |
| B. | 乙酸乙酯在碱性条件下水解更充分 | |
| C. | 工业合成氨反应:N2(g)+3H2(g)?2NH3 (g)△H=-92.4kJ/mol,采用较高的温度下进行 | |
| D. | 接触法制硫酸工业中通入过量空气与SO2反应 |
8.下列各组物质中,一定属于同系物的是( )
| A. | 乙二醇和丙三醇 | B. | C6H5-OH和C6H5-CH2OH | ||
| C. | C2H4O和C4H8O | D. | C2H6和C10H22 |
5.下列叙述正确的是( )
| A. | 液氯能使鲜花褪色 | |
| B. | 蒸馏实验中,温度计水银球应位于蒸馏烧瓶支管口处 | |
| C. | 只用BaCl2溶液就可以鉴别SO42-和CO32- | |
| D. | 在实验室里,硅酸钠溶液存放在带磨口玻璃塞的试剂瓶中 |
12.已知Fe3O4可表示为(FeO•Fe2O3),水热法制备Fe3O4纳米颗粒的总反应的离子方程式为3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O,下列说法正确的是( )
| A. | O2和S2O32-是氧化剂,Fe2+是还原剂 | |
| B. | 每生成1 mol Fe3O4,转移2 mol电子 | |
| C. | 若有2 mol Fe2+被氧化,则被Fe2+还原的O2为0.5 mol | |
| D. | 参加反应的氧化剂与还原剂的物质的量之比为1:5 |
7.下列关于溶液和胶体的叙述正确的是( )
| A. | 溶液是电中性的,胶体是带电的 | |
| B. | 胶体粒子可以通过半透膜而溶液不行,故可以用半透膜来分离胶体和溶液 | |
| C. | 一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有 | |
| D. | 溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动 |
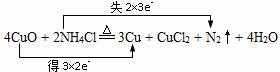 .
.