题目内容
燃煤烟气中含有大量的氮氧化合物(NOx)、二氧化硫和二氧化碳等,不宜直接排放到空气中,可采用以下措施对燃煤烟气进行处理.
(1)脱硝:选择性催化还原法的脱硝原理是在催化剂存在下,通入甲烷使氮氧化合物(NOx)转化为无害气体,发生如下反应:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ?mol-1
甲烷直接将NO2还原为N2的热化学方程式为 .
(2)脱硫:石灰石-石膏湿法烟气脱硫的工作原理是烟气中的二氧化硫与浆液中的碳酸钙以及鼓入的空气反应生成石膏(CaSO4?2H2O).某电厂用煤400吨(煤中含硫质量分数为2.5%),若燃烧时煤中的硫全部转化成二氧化硫,用石膏湿法烟气脱硫中有96%的硫转化为石膏,则可生产石膏 吨.
(3)脱碳:从脱硝、脱硫后的烟气中获取二氧化碳,用二氧化碳合成甲醇是碳减排的新方向.将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H3
①取五份等体体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线如下图1所示,则上述CO2转化为甲醇反应的△H3 0(填“>”、“<”或“=”).
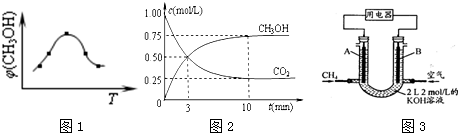
②在容积为1L的恒温密闭容器中充入1mol CO2和3mol H2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如上图2所示.若在上述平衡体系中再充0.5mol CO2和1.5mol H2O(g) (保持温度不变),则此平衡将 移动(填“向正方向”、“不”或“逆方向”)
③甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油.将CH4设计成燃料电池,其利用率更高,装置示意如上图3(A、B为多孔性碳棒).持续通入甲烷,在标准状况下,消耗甲烷体积VL.
a.V=67.2L时,溶液中离子浓度大小关系为 .
b.V=89.6L时,负极电极反应为 .
(1)脱硝:选择性催化还原法的脱硝原理是在催化剂存在下,通入甲烷使氮氧化合物(NOx)转化为无害气体,发生如下反应:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ?mol-1
甲烷直接将NO2还原为N2的热化学方程式为
(2)脱硫:石灰石-石膏湿法烟气脱硫的工作原理是烟气中的二氧化硫与浆液中的碳酸钙以及鼓入的空气反应生成石膏(CaSO4?2H2O).某电厂用煤400吨(煤中含硫质量分数为2.5%),若燃烧时煤中的硫全部转化成二氧化硫,用石膏湿法烟气脱硫中有96%的硫转化为石膏,则可生产石膏
(3)脱碳:从脱硝、脱硫后的烟气中获取二氧化碳,用二氧化碳合成甲醇是碳减排的新方向.将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H3
①取五份等体体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线如下图1所示,则上述CO2转化为甲醇反应的△H3

②在容积为1L的恒温密闭容器中充入1mol CO2和3mol H2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如上图2所示.若在上述平衡体系中再充0.5mol CO2和1.5mol H2O(g) (保持温度不变),则此平衡将
③甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油.将CH4设计成燃料电池,其利用率更高,装置示意如上图3(A、B为多孔性碳棒).持续通入甲烷,在标准状况下,消耗甲烷体积VL.
a.V=67.2L时,溶液中离子浓度大小关系为
b.V=89.6L时,负极电极反应为
考点:热化学方程式,化学电源新型电池,化学平衡的影响因素
专题:基本概念与基本理论
分析:(1)根据盖斯定律可写出热化学方程式;
(2)根据关系式S~SO2~CaSO4?2H2O来计算;
(3)①由图可知,到达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行;
②依据化学平衡三段式列式计算平衡浓度,结合平衡常数概念计算平衡常数,再充入物质,结合浓度商计算和平衡常数比较分析判断分析进行方向;
③n(KOH)=2mol/L×2L=4mol,可能先后发生反应CH4+2O2=CO2+2H2O、CO2+2KOH=K2CO3+H2O、K2CO3+CO2+H2O=2KHCO3;根据甲烷的量计算生成的二氧化碳的量,结合反应方程式判断反应产物及发生的反应.
(2)根据关系式S~SO2~CaSO4?2H2O来计算;
(3)①由图可知,到达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行;
②依据化学平衡三段式列式计算平衡浓度,结合平衡常数概念计算平衡常数,再充入物质,结合浓度商计算和平衡常数比较分析判断分析进行方向;
③n(KOH)=2mol/L×2L=4mol,可能先后发生反应CH4+2O2=CO2+2H2O、CO2+2KOH=K2CO3+H2O、K2CO3+CO2+H2O=2KHCO3;根据甲烷的量计算生成的二氧化碳的量,结合反应方程式判断反应产物及发生的反应.
解答:
解:(1)将反应CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ/mol和CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ/mol相加再约去公约数即可得反应CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g),其反应热△H=
=-867kJ/mol,热反应方程式为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol,
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol;
(2)S~SO2 ~CaSO4?2H2O
32 172
400t×2.5%×96% m
=
,解得m=51.6t,
故答案为:51.6;
(3)①由图可知最高点反应到达平衡,达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行,升高温度平衡吸热方向进行,逆反应为吸热反应,则正反应为放热反应,即△H3<0,故答案为:<;
②在容积为1L的恒温密闭容器中充入1mol CO2和3mol H2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如图1所示,平衡浓度c(CO2)=0.25mol/L,c(CH3OH)=0.75mol/L,则
CO2 (g)+3H2(g)?CH3OH(g)+H2O(g)
起始量(mol/L) 1 3 0 0
变化量(mol/L) 0.75 2.25 0.75 0.75
平衡量(mol/L) 0.25 0.75 0.75 0.75
平衡常数K=
=5.3
若在上述平衡体系中再充0.5mol CO2和1.5mol 水蒸气(保持温度不变),浓度商Q=
=5.3=K,则平衡不移动;
故答案为:不;
③n(KOH)=2mol/L×2L=4mol,可能先后发生反应CH4+2O2=CO2+2H2O、CO2+2KOH=K2CO3+H2O、K2CO3+CO2+H2O=2KHCO3;
a、当V=67.2 L时,n(CH4)=3mol,n(CO2)=3mol,则电池总反应式为3CH4+6O2+4KOH=K2CO3+2KHCO3+7H2O,则得到1molK2CO3和2molKHCO3的溶液,则c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
b、当甲烷V=89.6 L,n(CH4)=4mol,发生反应①②③,得到K2CO3和KHCO3溶液,则负极反应式为CH4-8e-+9OH-=9HCO3-+3H2O,故答案为:CH4-8e-+9OH-=9HCO3-+3H2O.
| △H1+△H2 |
| 2 |
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol;
(2)S~SO2 ~CaSO4?2H2O
32 172
400t×2.5%×96% m
| 32 |
| 400t×2.5%×96% |
| 172 |
| m |
故答案为:51.6;
(3)①由图可知最高点反应到达平衡,达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行,升高温度平衡吸热方向进行,逆反应为吸热反应,则正反应为放热反应,即△H3<0,故答案为:<;
②在容积为1L的恒温密闭容器中充入1mol CO2和3mol H2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如图1所示,平衡浓度c(CO2)=0.25mol/L,c(CH3OH)=0.75mol/L,则
CO2 (g)+3H2(g)?CH3OH(g)+H2O(g)
起始量(mol/L) 1 3 0 0
变化量(mol/L) 0.75 2.25 0.75 0.75
平衡量(mol/L) 0.25 0.75 0.75 0.75
平衡常数K=
| 0.75×0.75 |
| 0.25×0.753 |
若在上述平衡体系中再充0.5mol CO2和1.5mol 水蒸气(保持温度不变),浓度商Q=
| 0.75×(0.75+1.5) |
| (0.25+0.25)×0.753 |
故答案为:不;
③n(KOH)=2mol/L×2L=4mol,可能先后发生反应CH4+2O2=CO2+2H2O、CO2+2KOH=K2CO3+H2O、K2CO3+CO2+H2O=2KHCO3;
a、当V=67.2 L时,n(CH4)=3mol,n(CO2)=3mol,则电池总反应式为3CH4+6O2+4KOH=K2CO3+2KHCO3+7H2O,则得到1molK2CO3和2molKHCO3的溶液,则c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
b、当甲烷V=89.6 L,n(CH4)=4mol,发生反应①②③,得到K2CO3和KHCO3溶液,则负极反应式为CH4-8e-+9OH-=9HCO3-+3H2O,故答案为:CH4-8e-+9OH-=9HCO3-+3H2O.
点评:本题主要考查了热化学方程式、转化率、化学平衡常数、化学平衡状态的判断、影响平衡移动的因素、原电池原理分析应用,考点较多,有一定的综合性,掌握基础是关键,中等难度.

练习册系列答案
相关题目
下列化肥在空气中放置一段时间后,肥效降低的是( )
①氨水 ②硫酸铵 ③碳酸氢铵 ④氯化钾 ⑤尿素.
①氨水 ②硫酸铵 ③碳酸氢铵 ④氯化钾 ⑤尿素.
| A、①② | B、①③ | C、③④ | D、②⑤ |
设NA代表阿伏加德罗常数,下列说法正确的是( )
| A、73g氯化氢溶于水中,所含氯化氢分子数为2NA |
| B、标准状况下,18g水所含的原子数目为NA |
| C、标准状况下,22.4L氮气所含的原子数目为NA |
| D、常温常压下,2.8gCO和N2混合气体所含原子数为0.2NA |
 炼铁的还原剂CO是由焦炭和CO2反应而得.现将焦炭和CO2放入体积为2L的密闭容器中,高温下进行下列反应:C(s)+CO2(g)?2CO(g)△H=QkJ/mol.如图为CO2、CO的物质的量n随时间t的变化关系图.下列说法正确的是( )
炼铁的还原剂CO是由焦炭和CO2反应而得.现将焦炭和CO2放入体积为2L的密闭容器中,高温下进行下列反应:C(s)+CO2(g)?2CO(g)△H=QkJ/mol.如图为CO2、CO的物质的量n随时间t的变化关系图.下列说法正确的是( )A、0~lmin,v(CO)=1mol/(L?min);1~3min时,v(CO)=v(CO2);该反应的平衡常数表达式为k=
| ||
B、当容器内的压强不变时,该反应一定达到平衡状态,且
| ||
C、3min时温度由T1升高到T2,则Q>O,重新平衡时
| ||
| D、5min时再充入一定量的CO,c、b曲线分别表示n(CO)、n(CO2)的变化 |
实现下列变化需加入还原剂的是( )
| A、Fe2O3→Fe |
| B、Cu→Cu(NO3)2 |
| C、SO3→H2SO4 |
| D、HCl→Cl2 |
在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器在相同的温度和压强下时,下列说法正确的是( )
| A、两种气体的质量相等 |
| B、两容器中气体的密度相等 |
| C、两种气体的分子数目相等 |
| D、两种气体的氧原子数目相等 |
 已知X是一种盐,H是常见的金属单质,F、I是常见的非金属单质,E、G都是工业上重要的碱性物质,它们有如图所示的关系.试回答下列问题:
已知X是一种盐,H是常见的金属单质,F、I是常见的非金属单质,E、G都是工业上重要的碱性物质,它们有如图所示的关系.试回答下列问题: