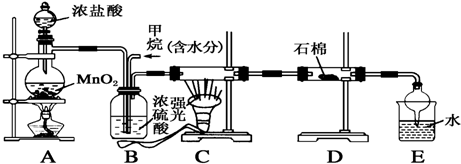
题目内容
10.在标准状况下,测得0.317g A气体的体积是100mL,计算此气体的相对分子质量.若A是双原子分子,则A可能是什么气体?分析 当摩尔质量以“g/mol”为单位时,其数值与该物质的相对分子质量数值相等,根据M=ρ.Vm来计算.
解答 解:标准状况下该气体的密度为ρ=$\frac{0.317g}{0.1L}$=3.17g/L,则该气体的摩尔质量为M=ρ.Vm=3.17g/L×22.4mol/L=71.0g/mol,所以该气体的相对分子质量为71,A可能是氯气,答:此气体的相对分子质量为71,A可能为氯气.
点评 本题考查有关物质的量的基本计算,难度不大,注意公式M=ρ.Vm的应用,难度不大.

练习册系列答案
相关题目
20.关于食物酸碱性的说法正确的是( )
| A. | 食物溶于水后的溶液pH<7,则为酸性食物 | |
| B. | 由C、H、O、N、S、P等元素组成的蛋白质是酸性食物 | |
| C. | 蔬菜、水果多含钾、钠、钙、镁等盐类及果酸,习惯称为酸性食物 | |
| D. | 柠檬是酸性食物 |
18.新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水.工业上常通过以下反应制备K2FeO4:2FeCl3+10KOH+3KClO═2K2FeO4+9KCl+5H2O,下列说法不正确的是( )
| A. | KClO为氧化剂,反应过程中被还原 | |
| B. | K2FeO4是还原产物 | |
| C. | K2FeO4中Fe为+6价,具有强氧化性,能杀菌消毒 | |
| D. | 若有2 mol FeCl3 发生反应,转移电子的物质的量为 6 mol |
15.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 0.1mol NaOH中含有的阴离子数目为0.1NA | |
| B. | 1L 0.05mol•L-1CH3COOH溶液中含有的H+数目为0.05NA | |
| C. | 标准情况下,44.8L CCl4含有的分子数为2NA | |
| D. | 反应:ClO2-+5Cl-+6H+═3Cl2+3H2O中,每生成1mol Cl2,转移的电子数为2NA |
12.有甲、乙、丙三瓶等体积、等物质的量浓度的硫酸.若将甲用水稀释,乙中加入适量的BaCl2溶液,丙不变,然后用等浓度的NaOH溶液中和,至完全反应时,所需NaOH溶液的体积是( )
| A. | 丙>乙>甲 | B. | 甲=丙>乙 | C. | 乙>丙>甲 | D. | 甲=乙=丙 |