题目内容
4.含H2SO449g的稀H2SO4与足量的Zn反应生成H2的物质的量为0.5mol.分析 Zn与硫酸反应生成硫酸锌和氢气,Zn足量,硫酸完全反应,反应中n(H2SO4)=n(H2),以此来解答.
解答 解:发生Zn+H2SO4=ZnSO4+H2↑,Zn足量,硫酸完全反应,反应中n(H2SO4)=n(H2)=$\frac{49g}{98g/mol}$=0.5mol,
故答案为:0.5mol.
点评 本题考查物质的量的计算,为高频考点,把握发生的反应、反应中物质的量关系为解答的关键,侧重分析与计算能力的考查,注意硫酸完全反应,题目难度不大.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
15.碳素墨水是一种以炭黑为颜料的黑色墨水,签署需要长时间保存的重要文件时,通常要求使用碳素墨水.这是利用了碳的( )
| A. | 导电性 | B. | 水溶性 | C. | 氧化性 | D. | 化学稳定性 |
12.日常生活和工业生产中常用到漂白剂.下列溶液具有漂白作用的有( )
| A. | NaClO溶液 | B. | 新制氯水 | C. | KOH溶液 | D. | 稀H2SO4 |
19.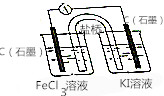 按如图所示装置(盐桥内含有KCl饱和溶液)线路连接后,可发现电流表指针明显偏转,说明发生了原电池反应,下列关于该电池的叙述正确的是( )
按如图所示装置(盐桥内含有KCl饱和溶液)线路连接后,可发现电流表指针明显偏转,说明发生了原电池反应,下列关于该电池的叙述正确的是( )
 按如图所示装置(盐桥内含有KCl饱和溶液)线路连接后,可发现电流表指针明显偏转,说明发生了原电池反应,下列关于该电池的叙述正确的是( )
按如图所示装置(盐桥内含有KCl饱和溶液)线路连接后,可发现电流表指针明显偏转,说明发生了原电池反应,下列关于该电池的叙述正确的是( )| A. | 左侧石墨为电池的正极,电极反应:Fe3++e-═Fe2+ | |
| B. | 右侧烧杯中发生还原反应,电极反应:2I--2e-═I2 | |
| C. | 右侧烧杯内溶液颜色变浅 | |
| D. | 盐桥中的K+流向右侧烧杯 |
10.电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点.在一定温度下,用0.1mol•L-1KOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1的盐酸和醋酸溶液,滴定曲线如图所示.下列有关判断正确的是( )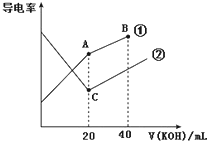

| A. | A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)═0.1mol•L-1 | |
| B. | B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+) | |
| C. | C点水电离的c(OH-)大于A点水电离的c(OH-) | |
| D. | A、B、C三点溶液均有Kw=c(H+)•c(OH-)=1.0×10-14 |
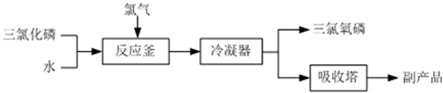

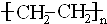 ;②C→D:CH3COOH+CH3CH2OH
;②C→D:CH3COOH+CH3CH2OH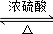 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.