题目内容
19.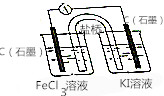 按如图所示装置(盐桥内含有KCl饱和溶液)线路连接后,可发现电流表指针明显偏转,说明发生了原电池反应,下列关于该电池的叙述正确的是( )
按如图所示装置(盐桥内含有KCl饱和溶液)线路连接后,可发现电流表指针明显偏转,说明发生了原电池反应,下列关于该电池的叙述正确的是( )| A. | 左侧石墨为电池的正极,电极反应:Fe3++e-═Fe2+ | |
| B. | 右侧烧杯中发生还原反应,电极反应:2I--2e-═I2 | |
| C. | 右侧烧杯内溶液颜色变浅 | |
| D. | 盐桥中的K+流向右侧烧杯 |
分析 该原电池反应为:2KI+2FeCl3═2FeCl2+I2,线路连接后,可发现电流表指针明显偏转,说明发生了原电池反应,负极碘离子失去电子发生氧化反应生成碘单质:2I--2e-═I2,正极铁离子得到电子生成亚铁离子:Fe3++e-═Fe2+,则左边的石墨为正极,右边的石墨为负极,外电路中电流从左边流向右边,据此进行解答.
解答 解:A.左侧石墨为原电池的正极,正极铁离子得到电子生成亚铁离子,发生反应为:Fe3++e-═Fe2+,故A正确;
B.右侧的石墨为负极,溶液中碘离子失去电子生成碘单质:2I--2e-═I2,该反应为氧化反应,故B错误;
C.右侧烧杯内铁离子得到电子转化成亚铁离子,溶液颜色变浅,故C正确;
D.左边的石墨为正极,右边的石墨为负极,外电路中电流从左边流向右边,盐桥中的K+流向作移动,故D错误;
故选AC.
点评 本题考查了原电池工作原理,题目难度中等,根据题干信息正确判断两极及发生反应原理为解答关键,注意掌握原电池工作原理,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.铝土矿为自然界中铝的重要存在形式,通常含有50%左右的Al2O3,以及SiO2、Fe2O3和MgO等成分.上述4种氧化物中,属于两性氧化物的是( )
| A. | Al2O3 | B. | SiO2 | C. | Fe2O3 | D. | MgO |
7.下列措施中,不能增大化学反应速率的是( )
| A. | Zn与稀硫酸反应制取H2时,加入蒸馏水 | |
| B. | Al在O2中燃烧生成Al2O3时,用铝粉替代铝片 | |
| C. | CaCO3与稀盐酸反应生成CO2时,适当升高温度 | |
| D. | 用KClO3固体分解制取O2时,固体中添加少量MnO2 |
5.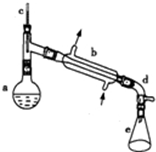 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图所示.可能用到的有关数据如下:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图所示.可能用到的有关数据如下:
a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.反应粗产物倒入f中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯.
回答下列问题:
(1)由环己醇制取环己烯的方程式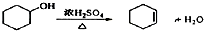 ;
;
(2)装置b的冷凝水方向是下进上出(填下进上出或上进下出);
(3)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(4)本实验中最容易产生的副产物所含的官能团名称为醚键.
(5)在分离提纯中,使用到的仪器f名称是分液漏斗,分离氯化钙的操作是过滤.
(6)合成过程中加入浓硫酸的作用是催化剂、脱水剂.
 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图所示.可能用到的有关数据如下:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图所示.可能用到的有关数据如下:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环乙醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
回答下列问题:
(1)由环己醇制取环己烯的方程式
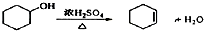 ;
;(2)装置b的冷凝水方向是下进上出(填下进上出或上进下出);
(3)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(4)本实验中最容易产生的副产物所含的官能团名称为醚键.
(5)在分离提纯中,使用到的仪器f名称是分液漏斗,分离氯化钙的操作是过滤.
(6)合成过程中加入浓硫酸的作用是催化剂、脱水剂.
2.可能造成臭氧层破坏的气体是( )
| A. | 汽车排放的尾气 | B. | 硫酸厂尾气 | C. | 居室装修废气 | D. | 卤代烃挥发 |
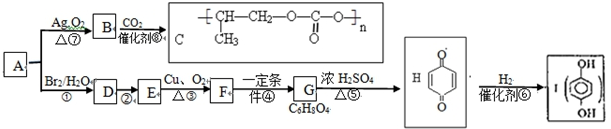
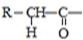 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$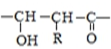
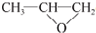 ;⑤的反应类型是消去反应.
;⑤的反应类型是消去反应.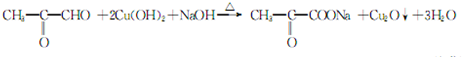 ;
;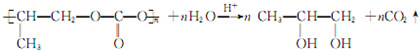 .
.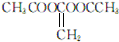 或
或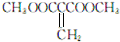 )(任写两种)
)(任写两种)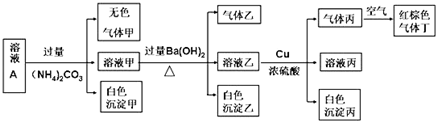
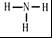 .
.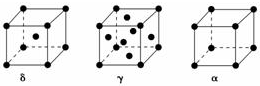 过渡元素Ti、Mn、Fe、Cu等可与C、H、O形成多种化合物.请回答下列问题:
过渡元素Ti、Mn、Fe、Cu等可与C、H、O形成多种化合物.请回答下列问题: