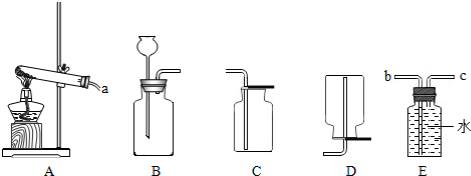
题目内容
加热NaHCO3和Na2CO3的混合物10g,充分反应后,冷却、干燥、称量,剩余固体为6.9g,求原混合物中Na2CO3的质量分数.
考点:有关混合物反应的计算
专题:元素及其化合物
分析:发生2NaHCO3
Na2CO3+CO2↑+H2O,固体质量减少10g-6.9g=3.1g,结合差量法计算.
| ||
解答:
解:设碳酸氢钠为xg,则
2NaHCO3
Na2CO3+CO2↑+H2O△m
168 62
x 3.1g
=
,解得x=8.4g,
则原混合物中Na2CO3的质量分数为
×100%=16%,
答:原混合物中Na2CO3的质量分数为16%.
2NaHCO3
| ||
168 62
x 3.1g
| 168 |
| x |
| 62 |
| 3.1g |
则原混合物中Na2CO3的质量分数为
| 10g-8.4g |
| 10g |
答:原混合物中Na2CO3的质量分数为16%.
点评:本题考查混合物的计算,为高频考点,把握发生的反应及差量法计算为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
下列有关实验现象的描述中,不正确的是( )
| A、灼烧Na与NaCl时,火焰颜色均显黄色 |
| B、钠在空气中燃烧后得到白色固体 |
| C、钠投入硫酸铜溶液中,会产生蓝色沉淀 |
| D、饱和碳酸钠溶液中滴加酚酞试液,溶液变红色 |

 )同分异构体的结构简式为
)同分异构体的结构简式为 的方案如下:
的方案如下:

 和
和 为原料,无机试剂自选,以最少步骤合成
为原料,无机试剂自选,以最少步骤合成 .写出合成路线(表示方法如方案一):
.写出合成路线(表示方法如方案一):
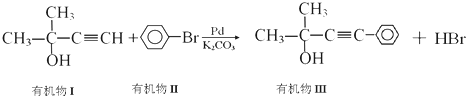
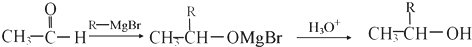
 有机物I
有机物I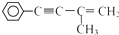 的反应条件是
的反应条件是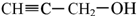 与CH3I能发生类似①的反应,该反应方程式是
与CH3I能发生类似①的反应,该反应方程式是