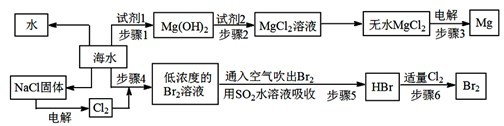
题目内容
下列说正确的是( )
【已知:HClO的Ka=3.0×l0-8;H2CO3的Ka1=4.3×l0-7,Ka2=5.6×l0-11;Ksp(BaSO4)=1.1×10-10;Ksp(BaCO3)=5.1×10-9】
【已知:HClO的Ka=3.0×l0-8;H2CO3的Ka1=4.3×l0-7,Ka2=5.6×l0-11;Ksp(BaSO4)=1.1×10-10;Ksp(BaCO3)=5.1×10-9】
| A、相同条件下,pH相同的NaClO和Na2CO3溶液,物质的量浓度前者小于后者 |
| B、常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7时:c(Na+)>c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)=c(OH-) |
| C、向饱和Na2CO3溶液中通入足量的CO2,溶液变浑浊,由此证明了NaHCO3溶解度比Na2CO3小 |
| D、氯碱工业使用的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质.除杂时,粗盐水中可先加入过量的BaCl2溶液,至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后滤去沉淀,所得滤液中仍含有一定量的SO42- |
考点:难溶电解质的溶解平衡及沉淀转化的本质,弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A、相同浓度时,酸性越弱,则对应盐的碱性越强;
B、根据CH3COONa溶液和稀盐酸的混合溶液中电荷守恒和物料守恒分析;
C、Na2CO3与CO2反应消耗水,而且NaHCO3的质量增大;
D、除杂时不能引入新的杂质,后加的试剂要把先加的多余的试剂除去.
B、根据CH3COONa溶液和稀盐酸的混合溶液中电荷守恒和物料守恒分析;
C、Na2CO3与CO2反应消耗水,而且NaHCO3的质量增大;
D、除杂时不能引入新的杂质,后加的试剂要把先加的多余的试剂除去.
解答:
解:A、Ka越大,对应酸的酸性越强,由题干中的数据可知相同浓度时,酸性:HClO>HCO3-,酸性越弱,则对应盐的碱性越强,则pH相同的NaClO和Na2CO3溶液,物质的量浓度前者大于后者,故A错误;
B、CH3COONa溶液和稀盐酸的混合溶液中电荷守恒为:c(Na+)+c(H+)=c(CH3COO-)+c(Cl-)+(OH-),pH=7,则c(H+)=c(OH-),所以c(Na+)=c(CH3COO-)+c(Cl-),由物料守恒可知c(Na+)=c(CH3COO-)+c(CH3COOH),所以c(Cl-)=c(CH3COOH),故B错误;
C、Na2CO3与CO2反应消耗水,使溶剂的质量减少,而且反应生成NaHCO3,NaHCO3质量增大,所以向饱和Na2CO3溶液中通入足量的CO2,溶液变浑浊,不能说明NaHCO3溶解度比Na2CO3小,故C错误;
D、氯碱工业使用的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质.除杂时,粗盐水中可先加入过量的BaCl2溶液,除去SO42-,至沉淀不再产生后,再加入过量的Na2CO3,除去Ca2+和Ba2+,再加NaOH除去Mg2+,充分反应后滤去沉淀;由于BaSO4和BaCO3的Ksp相差不大,当溶液中存在大量CO32-时,发生BaSO4(s)+CO32- (aq)=BaCO3(s)+SO42- (aq),BaSO4(s)会部分转化为BaCO3(s),所以所得滤液中仍含有一定量的SO42-,故D正确.
故选D.
B、CH3COONa溶液和稀盐酸的混合溶液中电荷守恒为:c(Na+)+c(H+)=c(CH3COO-)+c(Cl-)+(OH-),pH=7,则c(H+)=c(OH-),所以c(Na+)=c(CH3COO-)+c(Cl-),由物料守恒可知c(Na+)=c(CH3COO-)+c(CH3COOH),所以c(Cl-)=c(CH3COOH),故B错误;
C、Na2CO3与CO2反应消耗水,使溶剂的质量减少,而且反应生成NaHCO3,NaHCO3质量增大,所以向饱和Na2CO3溶液中通入足量的CO2,溶液变浑浊,不能说明NaHCO3溶解度比Na2CO3小,故C错误;
D、氯碱工业使用的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质.除杂时,粗盐水中可先加入过量的BaCl2溶液,除去SO42-,至沉淀不再产生后,再加入过量的Na2CO3,除去Ca2+和Ba2+,再加NaOH除去Mg2+,充分反应后滤去沉淀;由于BaSO4和BaCO3的Ksp相差不大,当溶液中存在大量CO32-时,发生BaSO4(s)+CO32- (aq)=BaCO3(s)+SO42- (aq),BaSO4(s)会部分转化为BaCO3(s),所以所得滤液中仍含有一定量的SO42-,故D正确.
故选D.
点评:本题考查了弱电解质的电离常数、溶液中电荷守恒和物料守恒的应用、碳酸钠越碳酸氢钠的转化、沉淀转化原理的应用等,题目涉及的知识点较多,侧重于考查学生的分析能力和知识应用能力,题目难度中等.

练习册系列答案
相关题目
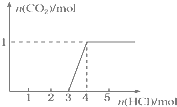 一定量CO2通入2L某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(CO2)的关系如图所示.下列有关叙述不正确的是( )
一定量CO2通入2L某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(CO2)的关系如图所示.下列有关叙述不正确的是( )| A、通入的CO2气体在标准状况下的体积约为22.4 L |
| B、原溶液中c(NaOH)=2mol/L |
| C、A溶液中含Na2CO3和NaHCO3 各1mol |
| D、A溶液中含有2molNaOH和1mol Na2CO3 |
下列事实,不能用勒夏特列原理解释的是( )
| A、氨水中加酸有利于NH+4的增多 |
| B、H2、Br2、HBr平衡混合气体加压后颜色变深 |
| C、增大压强有利于二氧化硫生成三氧化硫的反应 |
| D、升温不利于合成氨的反应 |
X、Y、Z、W、R属于短周期元素.已知它们都不是稀有气体元素,X的原子半径短周期最大,Y元素的原子最外层电子数为m,次层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m-n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2:1. 下列叙述错误的是( )
| A、X与Y形成的两种化合物中阴、阳离子的个数比均为1:2 |
| B、Y的氢化物比R的氢化物稳定,Y的氢化物熔沸点比R的氢化物高 |
| C、Z、W、R最高价氧化物对应水化物的酸性强弱顺序是R>W>Z |
| D、Y分别与Z、W、R以两种元素组成的常见化合物有5种,且它们晶体类型相同 |
将等质量的锌粒(wg)分别投入VL pH=2的盐酸和醋酸(含醋酸n mol),结果发现一种溶液中Zn有剩余,有关叙述正确的是( )
| A、0.325V<w<32.5n |
| B、产生H2的平均反应速率盐酸大于醋酸 |
| C、产生H2的量盐酸多于醋酸 |
| D、与醋酸反应时锌有剩余 |
下列液体,一定呈中性的是( )
| A、C(H+)=1×10-7mol?L-1的溶液 |
| B、pH=7的液体 |
| C、C(H+)=C(OH-)=1×10-6mol?L-1的溶液 |
| D、pH=6的水 |
下列变化发生了氧化反应的是( )
| A、Cl2+2e-=2Cl- |
| B、S2--2e-=S |
| C、Ag++e-=Ag |
| D、Cr2O72-+14H++6e-=2Cr3++7H2O |