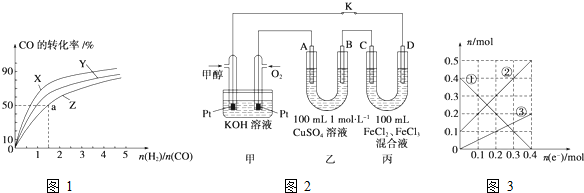
题目内容
银氨溶液可用于检测CO气体,实验室研究的装置如图:
(1)甲酸(HCOOH)遇浓硫酸分解生成CO和H2O,该反应体现浓硫酸的 (填“强氧化性”或“脱水性”).
(2)装置A中软管的作用是 .
(3)为验证上层清液中产物的成分,进行如下实验:
a.测得上层清液pH为10.
b.向上层清液中滴加几滴Ba(OH)2溶液,发现有白色浑浊出现,同时产生能使湿润红色石蕊试纸变蓝的气体.
c.取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象.
①实验c的目的是 .
②根据上述实验现象判断,上层清液中产物成分为 (填化学符号).
(4)设计实验证明黑色固体的成分是Ag:可供选择的试剂有:浓硫酸、浓硝酸、NaOH溶液、NaCl溶液.
取少量上述黑色固体,用蒸馏水洗净, ,说明黑色固体是Ag单质.(补充必要的实验内容及实验现象)
(5)从银氨溶液中回收银的方法是:向银氨溶液中加入过量盐酸,过滤,向沉淀AgCl中加入羟氨(NH2OH),充分反应后可得银,羟氨被氧化为N2.
①写出生成AgCl沉淀的离子反应 .
②若该反应中消耗6.6g羟氨,理论上可得银的质量为 g.
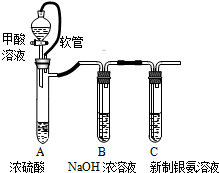 | 已知:银氨溶液制备反应为 Ag++2NH3?H2O═[Ag(NH3)2]++2H2O. 反应结束后试管C底部有黑色沉淀生成,分离出上层清液和底部黑色固体备用. |
(2)装置A中软管的作用是
(3)为验证上层清液中产物的成分,进行如下实验:
a.测得上层清液pH为10.
b.向上层清液中滴加几滴Ba(OH)2溶液,发现有白色浑浊出现,同时产生能使湿润红色石蕊试纸变蓝的气体.
c.取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象.
①实验c的目的是
②根据上述实验现象判断,上层清液中产物成分为
(4)设计实验证明黑色固体的成分是Ag:可供选择的试剂有:浓硫酸、浓硝酸、NaOH溶液、NaCl溶液.
取少量上述黑色固体,用蒸馏水洗净,
(5)从银氨溶液中回收银的方法是:向银氨溶液中加入过量盐酸,过滤,向沉淀AgCl中加入羟氨(NH2OH),充分反应后可得银,羟氨被氧化为N2.
①写出生成AgCl沉淀的离子反应
②若该反应中消耗6.6g羟氨,理论上可得银的质量为
考点:性质实验方案的设计,物质的检验和鉴别的实验方案设计
专题:物质检验鉴别题
分析:(1)甲酸(HCOOH)遇浓硫酸分解生成CO和H2O,C元素的化合价不变,甲酸脱水;
(2)A中软管可使下方生成的气体的气压转移到液体的上方;
(3)①取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象,与b对比;
②由a可知溶液为碱性,由b、c可知b中生成白色沉淀为碳酸钡,气体为氨气,即试管C中反应生成碳酸铵;
(4)Ag与浓硝酸发生氧化还原反应生成硝酸银、二氧化氮;
(5)①银氨溶液与盐酸反应生成AgCl和氯化铵;
②AgCl中加入羟氨(NH2OH),发生氧化还原反应,遵循电子守恒.
(2)A中软管可使下方生成的气体的气压转移到液体的上方;
(3)①取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象,与b对比;
②由a可知溶液为碱性,由b、c可知b中生成白色沉淀为碳酸钡,气体为氨气,即试管C中反应生成碳酸铵;
(4)Ag与浓硝酸发生氧化还原反应生成硝酸银、二氧化氮;
(5)①银氨溶液与盐酸反应生成AgCl和氯化铵;
②AgCl中加入羟氨(NH2OH),发生氧化还原反应,遵循电子守恒.
解答:
解:(1)甲酸(HCOOH)遇浓硫酸分解生成CO和H2O,C元素的化合价不变,甲酸脱水,则体现浓硫酸的脱水性,故答案为:脱水性;
(2)A中软管可使下方生成的气体的气压转移到液体的上方,即其作用为恒压,使甲酸溶液能顺利滴下,故答案为:恒压,使甲酸溶液能顺利滴下;
(3)①取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象,为b、c的对比试验,排除银氨溶液对产物检验的干扰,
故答案为:对比试验,排除银氨溶液对产物检验的干扰;
②由a可知溶液为碱性,由b、c可知b中生成白色沉淀为碳酸钡,气体为氨气,即试管C中HCOOH与银氨溶液反应生成碳酸铵,所以上层清液中产物成分为(NH4)2CO3或NH4+、CO32-,故答案为:(NH4)2CO3或NH4+、CO32-;
(4)Ag与浓硝酸发生氧化还原反应生成硝酸银、二氧化氮,则证明黑色固体的成分是Ag的方法为取少量上述黑色固体,用蒸馏水洗净,滴加浓硝酸,固体全部溶解并有少量红棕色气体产生,继续滴加NaCl 溶液,能产生白色沉淀,说明黑色固体为单质银,
故答案为:滴加浓硝酸,固体全部溶解并有少量红棕色气体产生,继续滴加NaCl 溶液,能产生白色沉淀;
(5)①银氨溶液与盐酸反应生成AgCl和氯化铵,该离子反应为Cl-+[Ag(NH3)2]++2H+=AgCl↓+2NH4+,故答案为:Cl-+[Ag(NH3)2]++2H+=AgCl↓+2NH4+;
②AgCl中加入羟氨(NH2OH),发生氧化还原反应,消耗6.6g羟氨,n(NH2OH)=
=0.2mol,由电子守恒可知,理论上可得银的质量为
×108g/mol=21.6g,故答案为:21.6.
(2)A中软管可使下方生成的气体的气压转移到液体的上方,即其作用为恒压,使甲酸溶液能顺利滴下,故答案为:恒压,使甲酸溶液能顺利滴下;
(3)①取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象,为b、c的对比试验,排除银氨溶液对产物检验的干扰,
故答案为:对比试验,排除银氨溶液对产物检验的干扰;
②由a可知溶液为碱性,由b、c可知b中生成白色沉淀为碳酸钡,气体为氨气,即试管C中HCOOH与银氨溶液反应生成碳酸铵,所以上层清液中产物成分为(NH4)2CO3或NH4+、CO32-,故答案为:(NH4)2CO3或NH4+、CO32-;
(4)Ag与浓硝酸发生氧化还原反应生成硝酸银、二氧化氮,则证明黑色固体的成分是Ag的方法为取少量上述黑色固体,用蒸馏水洗净,滴加浓硝酸,固体全部溶解并有少量红棕色气体产生,继续滴加NaCl 溶液,能产生白色沉淀,说明黑色固体为单质银,
故答案为:滴加浓硝酸,固体全部溶解并有少量红棕色气体产生,继续滴加NaCl 溶液,能产生白色沉淀;
(5)①银氨溶液与盐酸反应生成AgCl和氯化铵,该离子反应为Cl-+[Ag(NH3)2]++2H+=AgCl↓+2NH4+,故答案为:Cl-+[Ag(NH3)2]++2H+=AgCl↓+2NH4+;
②AgCl中加入羟氨(NH2OH),发生氧化还原反应,消耗6.6g羟氨,n(NH2OH)=
| 6.6g |
| 33g/mol |
| 0.2mol×[0-(-1)] |
| (1-0) |
点评:本题考查性质实验方案的设计,为高频考点,把握甲酸中含-CHO与银氨溶液的反应及产物的检验设计为解答的关键,侧重分析能力、计算能力及实验能力的综合考查,题目难度中等.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
下列各组物质中,全部属于纯净物的一组是( )
| A、福尔马林、白酒、醋 |
| B、甘油、冰醋酸、煤 |
| C、苯、汽油、无水酒精 |
| D、丙三醇、氯仿、乙醇钠 |
下列元素中,不属于主族元素的是( )
| A、磷 | B、钙 | C、铁 | D、溴 |
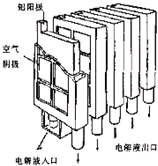 近年来,金属-空气电池的研究和应用取得很大进步这种新型燃料电池具有比能量高、对环境友好、应用场合多等多方面优点.铝-空气电池工作原理如图所示.关于金属-空气电池的说法不正确的是( )
近年来,金属-空气电池的研究和应用取得很大进步这种新型燃料电池具有比能量高、对环境友好、应用场合多等多方面优点.铝-空气电池工作原理如图所示.关于金属-空气电池的说法不正确的是( )| A、铝-空气电池(如图)中,铝作负极,电子通过外电路到正极 |
| B、为帮助电子与空气中的氧气反应,可使用活性炭作正极材料 |
| C、碱性溶液中,负极反应为Al(s)+3OH-(aq)═Al(OH)3(s)+3e-,每消耗2.7g Al(s),需耗氧6.72L(标准状况) |
| D、金属-空气电池的可持续应用要求是一方面在工作状态下要有足够的氧气供应,另一方面在非工作状态下能够密封防止金属自腐蚀 |
下列离子方程式书写正确的是( )
| A、少量CO2通入Ba(OH)2溶液中:CO2+2OH-═CO32-+H2O |
| B、NH4Al(SO4)2溶液中滴入Ba(OH)2溶液至SO42-恰好沉淀完全:NH4++Al3++2SO42-+2Ba2++4OH-═NH3?H2O+Al(OH)3↓+2BaSO4↓ |
| C、FeCl3溶液腐蚀铜线路板:Fe3++Cu═Fe2++Cu2+ |
| D、向NaHCO3溶液中滴入少量Ca(OH)2溶液:HCO3-+OH-═CO32-+H2O |